2. Скрининг супрессоров и энхансеров PEV позволил идентифицировать хромосомные белки и модификаторы хромосомных белков
PEV можно модифицировать различными факторами. Температура во время развития и количество гетерохроматина в геноме были первыми факторами, влияющими, как было показано, на степень мозаицизма. Как правило, повышение температуры во время развития (с 25 до 29°С) приводит к супрессии мозаицизма (утрате сайленсинга), тогда как более низкие температуры (например, 18°С) вызывают усиление мозаицизма (увеличение сайленсинга). Другие изменения в условиях культивирования, ускоряющие или замедляющие скорость развития, могут давать похожие эффекты. Сильная супрессия обнаруживается у мух, несущих дополнительную Y-хромосому (самки XXY и самцы XYY), тогда как у самцов без Y-хромосомы (Х0) обнаруживается значительное усиление. В целом дупликация гетерохроматинового материала подавляет, а делециии гетерохроматинового материала усиливают мозаицизм. Эти эффекты могут быть обусловлены титрованием фиксированного количества ключевых белков, необходимых для упаковки гетерохроматина. Первые мутации во втором сайте, супрессирующие или усиливающие PEV, были идентифицированы Шульцем (Schultz, 1950) и Споффордом (Spofford, 1967). В настоящее время приблизительно 150 генов предположительно рассматриваются как модификаторы локусов PEV.
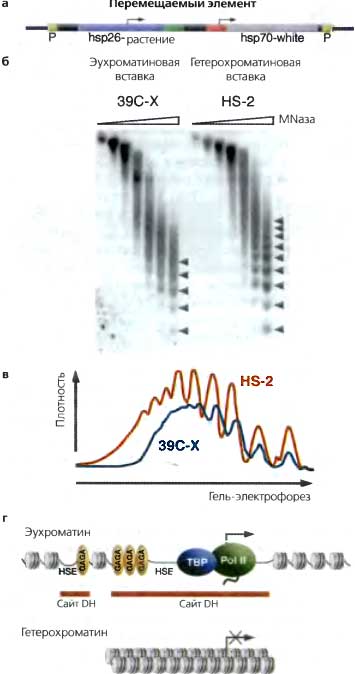
Рис. 5.3. Гетерохроматин упакован в регулярный нуклеосомный порядок
Мобильный элемент (а), несущий маркированную копию гена теплового шока для исследования и hsp70-управляемую копию white в качестве визуального маркера, можно использовать для изучения одного и того же гена в разных хроматиновых доменах. Ядра эмбрионов Drosophila из линии, несущей этот трансген в эухроматиновом домене (39С-Х; красные глаза), и из линии, несущей тот же самый трансген в гетерохроматиновом домене (HS-2; мозаичный глаз), были переварены возрастающими количествами фермента MNase, ДНК очистили и разогнали в агарозном геле, а Саузерн-блот гибридизировали с зондом, уникальным для трансгена (б). Линкерные сайты, расщепленные MNase, отмечены стрелками, (в) Сравниваются денситограммы последней дорожки каждой пробы (сверху вниз — слева направо). В гетерохроматине можно видеть набор 9—10 нуклеосом (красная линия) по сравнению с 5—6 нуклеосомами в эухроматине (синяя линия), что показывает наличие более регулярного «шага» в первом случае, (г) Схематическое представление этих результатов (б, в — с любезного разрешения из Sun et al., 2001, с изменениями [©American Society for Microbiology])
Мутации Su(var) и E(var) идентифицируют гены, причинно связанные с началом сайленсинга гетерохроматиновых генов при PEV [with the onset of hetero-chromatic gene silencing in PEV]. Молекулярный анализ этих генов сыграл существенную роль в углублении понимания механизмов, приводящих к формированию гетерохроматина и сайленсингу генов. В большинстве случаев модифицирующее влияние мутаций на PEV является доминантным, и гетерозиготы Su(var)/+ или E(var)/+ демонстрируют фенотип с подавленным или усиленным PEV (рис. 5.1). Эффективное выделение и детальный генетический анализ мутаций Su(var) и E(var) зависят от наличия подходящей для эксперимента PEV-перестройки. Хотя было описано большое число PEV-перестроек (Flybase, 2005), лишь немногими из них можно легко воспользоваться для эффективного генетического скрининга и изоляции доминантных мутаций-модификаторов. Одна из наиболее полезных для такой экспериментальной работы PEV-перестроек— In(1)wm4 (Muller 1930). Эта перестройка обусловливает мозаицизм по white — фенотип, легко различимый на глазах взрослых мух, как показано на рис.5.1. Пенетрантность мозаицизма по white у wm4 является 100 %-ной, так что каждая муха в исходном штамме [the starting stock] имеет глаза с белой пятнистостью. Инактивация гена white не влияет на жизнеспособность или фертильность, что обусловливает возможность неограниченной работы с мухами, гомозиготными по wm4.
В перестройке wm4 ген white в результате инверсии оказывается в непосредственной близости с гетерохроматиновым материалом Х-хромосомы, локализованным на дистальной границе ядрышкового организатора (Cooper, 1959). Этот район содержит тандемные порядки мобильных элементов типа R1; гетерохроматиновая точка разрыва In(1)wm4 находится внутри единицы повтора R1 (A. Ebert and G. Reuter, неопубликовано). После воздействия Х-лучами или EMS (этанметилсульфонат, химический мутаген) были изолированы ревертанты wm4, имеющие фенотип w+ (Tartof et al., 1984; Reuter et al., 1985). Анализ более 50 ревертантных хромосом w+ (все они обнаружили реинверсию или транслокацию гена white в соседство с эухроматином) позволил предположить, что гетерохроматиновый материал, фланкирующий непосредственно точку разрыва, вызывает инактивацию гена white у wm4. Большинство ревертантов снова обнаруживают белую пятнистость, если вводятся сильные мутации E(var), что заставляет предполагать, что некоторые гетерохроматиновые последовательности после перемещения остаются ассоциированными с геном white. Эти исследования позволяют считать повторяющуюся ДНК (в данном случае повторы R1) мишенью для формирования гетерохроматина.
Большинство известных мутаций-модификаторов PEV были изолированы с использованием сенсибилизированного генетического фона. Для изоляции доминантных супрессорных мутаций тест-генотип содержит доминантный энхансер, тогда как в схемах для изоляции энхансерных мутаций используется доминантный супрессор (Dorn et al., 1993b). Если тест-генотип содержит энхансер мозаичности, все мухи wт4 имеют белые глаза, и исключения, имеющие пятнистые или красные глаза, указывают на вновь индуцированные мутации Su(var). Соответственно, в тест-линии с доминантным супрессором все мухи wт4 имеют красные глаза, а исключительные мухи с мозаичным фенотипом указывают на вновь индуцированные мутации E(var). Эти сенсибилизированные генетические схемы благоприятствуют изоляции сильно доминантных мутаций Su(var) и E(var), которые оказались очень полезными для детального генетического анализа.
С использованием этого подхода в разных опытах по скринингу просмотрели более миллиона мух, и были изолированы более 140 мутаций Su(var) и 230 мутаций
E(var) (Schotta et al., 2003). Мутации были индуцированы EMS, Х-лучами или ремобилизацией элементов Р. Еще один набор мутаций Su(var) был изолирован в ходе прямого скрининга с wm4 (Sinclair et al., 1983). Скрининг с хромосомой Df(l'J), демонстрирующей сильный мозаицизм по гену yellow (маркер, желтая окраска тела), привел к изоляции 70 мутаций-модификаторов PEV (Donaldson et al., 2002). Кроме того, скрининг на доминантные модификаторы экспрессии транспозонного репортерного гена позволил идентифицировать несколько мутаций с эффектом Su(var) (Birchler et al., 1994). Известно, что выборка критических регуляторных генов даун — регулируется генами группы Polycomb (PcG) и ап — регулируется генами группы trithorax (trxG). В прямых тестах относительно немногие мутации в генах PcG модифицируют PEV (например, Sinclair et al., 1998). Напротив, многие мутации в генах trxG являются энхансерами PEV (Dorn et al., 1993а; Farkas et al., 1994).
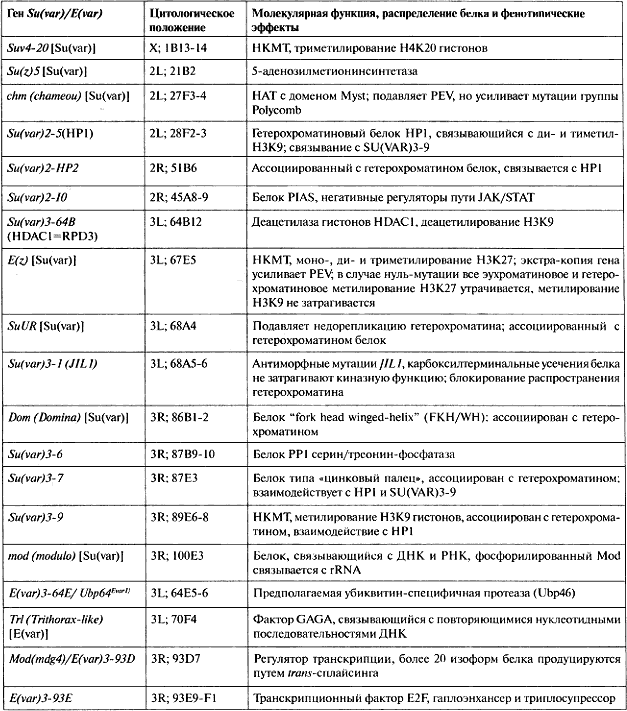
В совокупности этот скрининг позволил идентифицировать большое число доминантных мутаций Su(var) и E(var). По данным выполненного к настоящему времени генетического анализа общее число мутаций Su(var) и E(var) можно оценить как приблизительно 150. Большое число генов Su(var) и E(var) с почти идентичными фенотипическими эффектами иногда приводит к несоответствиям в генетической номенклатуре. Чаще всего символы генов Su(var) и E(var) комбинируются с цифрами, указывающими хромосому, в которой локализована данная мутация, с номером гена и номером аллели Так, Su(var)3-917 символизирует аллель 17 девятого гена Su(var), идентифицированного в третьей хромосоме. В настоящее время были тщательно картированы лишь около 30 соответствующих генов и идентифицированы соответствующие аллели (табл. 5.1). Зависящие от дозы эффекты наблюдались для примерно одной трети идентифицированных генов, с использованием серии перекрывающихся нехваток и дупликаций. В этих случаях уменьшение количества генных продуктов из-за утери одной копии гена неизменно приводит к модификации мозаичного фенотипа. Делеции этих локусов Su(var) или E(var) супрессируют или, соответственно, усиливают сайленсинг генов. Исследования с использованием дупликаций позволили идентифицировать новые локусы-модификаторы, которые обнаруживают противоположное (антиподное) влияние на PEV, если путем дупликации или с помощью инсерции трансгена вводится лишняя копия данного гена. Общее число генов-модификаторов PEV, обнаруживающих зависящие от дозы эффекты, оценивается примерно в 15—20 (Schotta et al., 2003).
Если утрата одной копии гена приводит к супрессии PEV, а присутствие трех копий гена ведет к усилению PEV, это позволяет предполагать, что для установления гетерохроматина требуется, в стоихиометрических количествах, продукт, кодируемый этим геном, с сопутствующим сайленсингом гена (рис. 5.2). Были детально охарактеризованы три таких локуса, Su(var)2-5 (кодирующий НР1), Su(var)3-7 (кодирующий белок типа «цинковых пальцев») и Su(var)3-9 (кодирующий метилтрансферазу лизина гистонов). Su(var)2-5 был клонирован путем скрининга библиотеки экспрессии кДНК с помощью моноклонального антитела, распознающего гетерохроматин (James and Elgin, 1986). Кодируемый белок, ассоциированный с гетерохроматином, был впоследствии обозначен НР1 (белок гетерохроматина 1). Гибридизация in situ с использованием выделенной клонированной ДНК позволила идентифицировать ген в районе 28—29 политенных хромосом,
Таблица 5.1. Генетически установленные гены Su(var) и E(var) и их молекулярные функции
См. оригинальное цитирование во Flybase.
где ранее был картирован Su(var)2-5- Анализ нуклеотидной последовательности ДНК мутантных аллелей подтвердил, что локус Su(var)2-5 в положении 28F1-2 на хромосоме кодирует HP 1 (Eissenberg et al., 1990), HP1 содержит два консервативных домена, аминотерминальный хромодомен и карбокситерминальный домен «chromoshadow» (Paro and Hogness, 1991), и взаимодействует с несколькими другими хромосомными белками. Su(var)3- 7 был сперва цитогенетически картирован (с помощью серии перекрывающихся делеций и дупликаций) в районе 87Е1-4 в третьей хромосоме. Этот район был проанализирован на уровне ДНК как часть первой «прогулки по хромосоме» [chromosomal walk], выполненной у Drosophila (Bender et al., 1983). С помощью серии перекрывающихся геномных клонов Su(var)3-7был определен в пределах фрагмента ДНК величиной 7.8 т.о., который обладал трипло-энхансерным влиянием на репортер, обнаруживающий мозаичность (Reuter et al., 1990). Su(var)3-7кодирует белок с семью регулярно расположенными [regularly spaced] «цинковыми пальцами» — доменами, которые, как было показано, функционируют в связывании с ДНК (Cleard and Spierer, 2001). Su(var)3-9 был клонирован с помощью таггирования транспозоном P-элементом (Tschiersch et al., 1994). Ген Su(var)3-9 у Drosophila (и у всех других голометаболических насекомых, изученных к настоящему времени) образует бицистронную единицу с геном, кодирующим eIF2y (Krauss and Reuter, 2000). Поскольку транскрипционная единица Su(var)3-9 не имеет интронов, вполне вероятно, что Su(var)3-9 был вставлен в интрон гена eIF2y путем ретротранспозиции. Белок SU(VAR)3-9 содержит хромодомен в своем аминотерминальном участке и домен SET (идентифицированный впервые в белках SU(VAR)3-9, ENHANCER OF ZESTE [E(Z)] и TRITHORAX) (Jones and Gelbart, 1993; Tschiersch et al., 1994) на своем карбоксильном конце. Этот белок является метилтрансферазой гистонов, специфически модифицирующей гистон H3 по лизину 9.
Были описаны семь разных мутантных аллелей Su(var)2-5, в том числе миссенс-мутации в хромодомене, преждевременные стоп-кодоны и ошибки сплайсинга (Eisenberg et al., 1992). Мутации Su(var)3-7 были получены с помощью гомологичной рекомбинации (Seum et al., 2002); дополнительные аллели были выявлены как супрессоры сайленсинга, зависимого от P-элемента (Bush-еу and Locke, 2004). Сорок мутантных аллелей Su(var)3-9 были выявлены и определены на молекулярном уровне (Ebert et al., 2004). Иммуноцитологический анализ с использованием специфических антител или химерных белков слияния, экспрессируемых трансгеном [transgene-expressed fusion proteins], показал, что все три белка преимущественно ассоциированы с гетерохроматином (см. ниже и рис. 5.4) (James et al., 1989; Cleard et al., 1997; Schotta et al., 2002). Сильная колокализация особенно очевидна для НР1 и SU(VAR)3-9. Эти белки также связываются с теломерами и в ряде эухроматиновых сайтов (Fanti et al., 1998; Schotta et al., 2002).
Несколько инсерций P-элемента, несущих репортерный ген w+ в теломерные районы, обнаруживают белую пятнистость. Этот феномен называется теломерным эффектом положения (ТРЕ). Упаковка, подобная гетерохроматину, наблюдается в ассоциированных с теломерами сателлитных последовательностях (TAS), кластерах повторяющейся ДНК, расположенных проксимально по отношению к ретровирусным элементам НеТ-А и TART, составляющим теломеры Drosophila (Cryderman et al., 1999a). В целом, не было обнаружено модификации ТРЕ мутациями в известных генах-модификаторах, хотя НР1 важен для целостности теломер. В клетках с недостаточностью по этому белку хромосомы часто сливаются в области своих теломер (Fanti et al., 1998). У Drosophila в ходе недавнего скрининга не было обнаружено никаких /гая5-действуюших доминантных модификаторов ТРЕ (Mason et al., 2004), что заставляет предполагать, что эти участки сайленсированы двумя (или несколькими) независимыми механизмами.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК