2.5. Регуляция эпигенетической программы у мышей после спецификации PGC
Активное эпигенетическое программирование и репрограммирование в линии половых клеток продолжается после спецификации PGC (Seki et al., 2005). Этот период развития отмечен стиранием некоторых репрессивных эпигенетических модификаций, что позволяет клеткам половой линии приобрести плюрипотентные характеристики, которые, возможно, являются предпосылкой последующей тотипотентности.
Основными наблюдаемыми изменениями являются исчезновение H3K9me2 на стадии Е8.0 и уменьшение уровня HP 1а на стадии Е 9.0 в эухроматиновых и перицентрических гетерохроматиновых районах (Seki et al., 2005). Вместе с тем в PGC, начиная со стадии Е8.0 и далее, происходит уменьшение общего уровня метилирования ДНК. В то время как происходит уменьшение H3K9me2 и ДНК метилирования, наблюдается прогрессивное увеличение H3K27me3, репрессивной модификации, опосредованной Ezh-белком группы polycomb в, Ezh (рис. 20.5). Потеря ДНК метилирования сопровождается репрессией de novo ДНК-метилтрансфераз Dnmt За и Dnmt3b, а также временным уменьшением Dnmtl. Следует заметить, что потеря ДНК метилирования H3K9me2 также совпадает с возобновлением экспрессии гена Nanog, который является ключевым геном, связанным с плюрипотентностью (Yamaguchi et al., 2005). Nanog впервые экспрессируется во внутренних клетках на стадии поздней морулы и в клетках внутренней массы бластописты. Однако экспрессия этого гена быстро уменьшается после имплантации и возобновляется только после спецификации PGC. Вместе с экспрессией других плюрипотентных генов, включая Oct4, Sox2 и Esgl, это показывает, что половые клетки приобретают плюрипотентные свойства (рис. 20.5).
Дополнительные события интенсивного эпигенетического программирования происходят после попадания PGC в развивающиеся гонады (Surani et al., 2004). Во-первых, происходит увеличение метилирования H3K4 и ацетилирования H3K9, что является характерным для пермиссивного состояния хроматина, исключающего H3K9те. Кроме того, происходит повсеместное геномное деметилирование ДНК (рис. 20.5), включающее стирание родительских импринтов и метилирования в единичных копиях генов В женских эмбрионах в это время происходит реактивация неактивной Х-хромосомы.
Хотя существует эффективный механизм стирания «приобретенных» эпигенетических модификаций, не все эпигенетические метки полностью удаляются во время развития половых клеток. Например, метилирование ДНК семейства транспозонов IAP репрограммируется только частично (Lane et al., 2003). Неполное удаление эпигенетических меток, очевидно, может привести к эпигенетическому наследованию через линию половых клеток. И этому имеется ряд примеров у млекопитающих (Chong and Whitelaw, 2004) Чтобы понять, насколько широко этот феномен распространен и сколько генов могут быть в него вовлечены, нужны дальнейшие исследования.
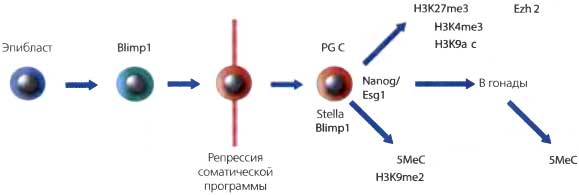
Рис. 20.5. Ранние эпигенетические события во время спецификации половых клеток
Экспрессия Blimp1 в потомках эпибластных клеток приводит к подавлению экспрессии соматической генной программы (красный). За этим следует экспрессия Stella, Nanog и Esgl, увеличение H3K27me3, H3K4me3 и H3K9ас, утрата H3K9me2 и 5МеС. Примордиальные половые клетки входят в гонады, после чего происходит дальнейшее эпигенетическое репрограммирование
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК