3. Роль метилирования ДНК при раковых заболеваниях
Первое открытие того, что ДНК кроме четырех оснований, содержит 5-метилцитозин, непосредственно включенный в ДНК, вскоре привело к предположению, что изменения в метилировании ДНК могут играть роль в онкогенезе (табл. 24.2). За последние 40 лет было проведено много исследований, которые показывали различия в паттернах распределения 5-метилцитозина ДНК человека между раковыми и нормальными клетками. Среди них есть как минимум три основных способа, с помощью которых метилирование CpG может участвовать в онкогенном фенотипе. Они включают в себя гипометилирование ракового генома, локальное гиперметилирование промоторов генов-супрессоров опухоли и прямой мутагенез (рис. 24.1) (Jones and Laird, 1999; Jones and Baylin, 2002; Herman and Baylin, 2003). Хотя каждое из этих отклонений само по себе могло бы способствовать возникновению раковых заболеваний у человека, может быть, особенно важно то, что они все имеют место одновременно, показывая, таким образом, что нарушения гомеостаза эпигенетических механизмов — это главные причины, вызывающие рак у людей.
Наиболее известное и раньше других установленное изменение в паттернах метилирования ДНК у раковых клеток — это общее уменьшение данной модификации, приводящее к нестабильности генома (дополнительное обсуждение см. в главе 18). Хорошо известно, что это является ключевым признаком рака у человека (Fein-berg and Vogelstein, 1983; Feinberg et al., 1988; Jones and Laird, 1999; Jones and Baylin, 2002; Herman and Baylin, 2003). В более поздний период времени возрастающий объем данных показал, что аномальное метилирование островков CpG в 5’-районах генов, относящихся к раковым заболеваниям, является составной частью их транскрипционного сайленсинга, обеспечивая альтернативный механизм мутаций для инактивации генов с функциями подавления опухоли (Jones and Laird, 1999; Jones and Baylin, 2002; Herman and Baylin, 2003). Наконец, в дополнении к вышеописанной роли метилирования цитозина в дестабилизации генома и генном сайленсинге, 5-метилцитозин сам по себе является высоко нестабильным и, поэтому, мутабельным основанием. Это напрямую может вносить свой вклад в развитие раковых заболеваний, вызывая мутации типа транзиций, при которых meCpG превращается в TpG (Rideout et al., 1990). Тот факт, что эти модификации столь распространены при раковых заболеваниях, и, как сейчас известно, приводят напрямую к канцерогенезу, также создает новые возможности терапевтической реверсии, направленной на эпигенетические изменения (Egger et al., 2004).
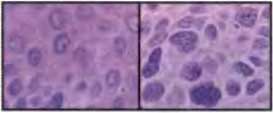
Рис. 24.3. Структурные изменения хроматина в раковых клетках
Эти две микрофотографии сделаны у пациента со сквамозноклеточной карциномой кожи. На левой части показаны нормальные эпидермальные клетки, расположенные в одном миллиметре от прилегающей опухоли и показанные при том же увеличении на правой части рисунка Хроматин, окрашенный пурпурным цветом, благодаря его сродству к гематоксилину, оказывается гораздо более грубым и гранулярным в раковых клетках, чем в нормальном эпидермисе. Такие различия в окраске хроматина используются патологами в качестве диа гностических критериев раковых заболеваний
Таким образом, в настоящее время признается, что критическую роль в канцерогенезе человека играет метилирование цитозина в ДНК. Почти все гены человека содержат остатки метилированного цитозина в своих кодирующих областях, для которых в течение некоторого времени известно непропорциональное участие в образовании болезнетворных мутаций. Метилирование 5 углерода в цитозиновом кольце повышает частоту гидролитического дезаминирования этого основания в двунитевой ДНК. Однако продуктом дезаминирования 5-метилцитозина является в тимин, а не урацил (см. рис. 3.12). Механизмы репарации ДНК впоследствии менее эффективны при восстановлении неправильных сочетаний оснований в ДНК, вызванных дезаминированием. Известно, что метилированные сайты CpG производят более 1/3 всех мутаций типа транзиций, возникающих в зародышевой линии человека (Rideout et al., 1990). Это также справедливо для генов, вызывающих рак, таких как р53 (Rideout et al., 1990). Более удивительным является наблюдение, что этот механизм также принимает существенное участие в образовании инактивирующих мутаций в генах-супрессорах опухоли в соматических тканях. Например, более 50% всех мутаций р53, которые приобретаются при спорадических раковых заболеваниях толстой и прямой кишки, имеют место в сайтах метилирования цитозина (Greenblatt et al., 1994). Таким образом, модификация ДНК ДНК-метилтрансферазами (DNMTs) существенно повышает риск получения рака с помощью такого эндогенного механизма.
Было также показано, что метилирование цитозиновых остатков поддерживает образование канцерогенных аддуктов присоединения между ДНК и канцерогенами, такими как бензопирен из сигаретного дыма. В этом случае, метилирование цитозинового остатка повышает образование канцерогенных аддуктов между соседним гуаниновым остатком и бензопирендиолэпоксидом, приводящее к повышению вероятности мутаций в сайтах CpG в легких курильщиков (Greenblatt et al., 1994; Pfeifer et al., 2000). Интересно, что метилирование может также изменять частоту мутаций в гене р53 в коже, экспонированной солнечному свету (Greenblatt et al., 1994; Pfeifer et al., 2000). Это происходит из-за того, что метиловая группа смещает спектр поглощения цитозина в диапазон падающего солнечного света, тем самым повышая образование пиримидиновых димеров в ДНК клеток кожи. Таким образом, эта эпигенетическая модификация ДНК не только повышает спонтанный мутагенез, но также может влиять на то, как ДНК взаимодействует с канцерогенами и ультрафиолетом (Pfeifer et al., 2000).
Гипометилирование ДНК, которое было давно отмечено в опухолях животных и человека (табл. 24.2), влияет на стабильность хромосом и повышает шанс анеуплоидии. Геномная нестабильность — это признак ракового заболевания, и повышенная ломкость хромосом, вызываемая гипометилированием саттелитных и других последовательностей, может, по-видимому, приводить к образованию раковых заболеваний путем уменьшения стабильности генома (Narayan et al., 1998; Gaudet et al., 2003). Конкретные механизмы, с помощью которых достигается эта нестабильность, все еще не полностью поняты, но они легко могут быть результатом измененных взаимодействий ДНК и белков, вызванных гипометилированием.
Таблица 24.2. Временная шкала, проясняющая роль метилирования ДНК при раковых заболеваниях
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК