4.1. Дифференцировка плазматических клеток
Завершение рекомбинации V(D) J и экспрессия рецептора иммуноглобулина (Ig) на поверхности В-клетки маркируют конец антиген-независимой фазы В-лимфопоэза. Начиная с этой точки отсчета, судьба В-клеток начинает зависеть от сигнала рецептора, индуцированного антигеном (Rajewsky, 1996). В отсутствие антигена периферические В-клетки поддерживаются в покоящемся состоянии, где их выживание обеспечивается тонизирующими сигналами с BCR клеточной поверхности (Kraus et al., 2004). Сравнение организации хроматина в покоящихся и активированных В-клетках показывает, что покой В-клеток характеризуется низкими уровнями общего метилирования гистонов (Baxter et al., 2004). Относительно высокие уровни ацетилирования гистонов в покоящихся В-клетках остаются стабильными в процессе активации клеток (Baxter et al., 2004). Общее снижение метилирования лизинов гистонов, включая возможное отсутствие метилирования гистона H3K9, коррелирует с отсутствием других признаков конститутивного хроматина, таких как ассоциация Ikaros и связывание НР1 в покоящихся В-клетках (Baxter et al., 2004). Активация В-клеток восстанавливает метилирование гистонов, которое приводит к увеличению активной метки H3K4me3 на генах, требующихся для функционирования В-клетки (Рах5), и к одновременному повышению репрессивной модификации H3K9me2 на «молчащих» генах (Dntt) (Baxter et al., 2004). Реорганизация хроматина, индуцированная активацией, может поддерживать идентичность В-клетки в течение иммунного ответа. Однако геном В-клетки должен оставаться подверженным перепрограммированию, вызванному антигеном, так как активированные В-клетки после первой встречи с антигеном способны дифференцироваться прямо в плазматические клетки, продуцирующие антитела (Calame et al., 2003).
Как альтернатива, антигенная стимуляция может инициировать реакцию зародышевого центра. В процессе этой реакции зрелые IgMlow IgDhlgh В-клетки включают свои иммуноглобулиновые изотипы и производят мутации в своих генах Ig с помощью цитидиндеаминазы, индуцированной активированием (AID; Honjo et al., 2004). Белки Ig, возникшие в результате этих процессов, идеально подходят для дифференцировки и поддержки В-клеток памяти, или для развития плазматических клеток, которые продуцируют антитела с высоким сродством к определенному антигену (Honjo et al., 2004). Время реакций зародышевого центра и превращение В-клеток в плазматические клетки регулируются двумя взаимоисключающими репрессорами транскрипции — Вс16 и Blimp 1 (рис. 21.10) (Turner et al., 1994; Ye et al., 1997). Bcl6 экспрессируется на низком уровне в зрелых наивных В-клетках, но быстро ап-регулируется в некоторых В-клетках после антигенной стимуляции (Fukuda et al., 1997). Клетки, которые не ап-регулируют Вс16, после встречи с антигеном дифференцируются в плазматические клетки, которые служат начальным источником антител с низкой аффинностью (Fukuda et aL, 1997).
Наоборот, В-клетки, которые ап-регулируют Вс16, входят в реакцию зародышевого центра (Fukuda et al., 1997) и поддерживаются как В-клетки за счет Вс16-опосредованной репрессии генов, которые контролируют дифференцировку плазматических клеток (Shaffer et al., 2000). Одной из ключевых мишеней Вс16 является ген Prdm1, кодирующий транскрипционный фактор Blimp1 (рис. 21.10). Интересно, что, оказывается, Рах5 помогает Вс16 в репрессии гена Blimp1 (Prdm1) (рис. 21.10) (Delogu et al., 2006). Однако, начав однажды экспрессироваться, Blimp 1 аннулирует транскрипционную программу В-клеток, включая экспрессию Вс16 и Рах5, и одновременно вызывает транскрипцию генов, специфичных для плазматических клеток (Shaffer et al., 2002; Calame et al., 2003). Bcl6 и Blimp 1 используют широкий арсенал репрессивных механизмов для инактивации транскрипции генов. Один характерный аспект Вс16 — это использование ацетилирования лизина за рамками модификации гистонов, чтобы контролировать репрессию генов (Bereshchenko et al., 2002). Вс16 взаимодействует с МТАЗ, субъединицей корепрессорного комплекса Mi-2/NuRD, который в высокой степени экспрессируется в В-клетках зародышевого центра (Fujita et al., 2004). Ассоциация Вс16 с комплексом Mi-2/ NuRD, содержащим МТАЗ, необходима для репрессии гена, так как истощение МТАЗ, опосредованное RNAi, ведет к реактивации репрессированных Вс16 генов-мишеней в В-клетках (Fujita et al., 2004). Функция репрессии комплекса Вс16/МТАЗ/ Mi-2/NuRD зависит от статуса ацетилирования остатков лизина как в Вс16, так и в гистонах, связанных с локусом репрессированного гена. Для осуществления взаимодействия центрального домена Вс16 с МТАЗ он должен быть деацетилирован, тогда как репрессия гена посредством комплекса МТАЗ/ Mi-2/NuRD зависит от деацетилаз гистонов HDAC1 и HDAC2 класса I (Fujita et al., 2004).
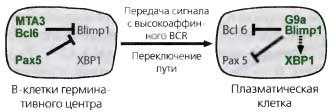
Рис. 21.10. Транскрипционная репрессия определяет судьбу В-клеток зародышевого центра и плазматических клеток
Рах5 и Вс16 (вместе с МТАЗ) регулируют программу экспрессии генов В-клеток и поддерживают судьбу В-клеток зародышевого центра (GC) посредством транскрипционной репрессии Blimp 1 — регулятора плазматических клеток. Сильный сигнал BCR в конце развития В-клеток GC ведет к деградации белка Вс16 и сопровождающей ее экспрессии Blimp 1, которая впоследствии репрессирует Вс16 и Рах5 и вместе с ХВР1 индуцирует программу транскрипции, характерную для плазматических клеток. Наиболее вероятно, что Blimp1 активирует экспрессию ХВР1 косвенно как часть реакции на развернутый белок, посредством индукции экспрессии секретируемых иммуноглобулинов. Детальное описание см. в тексте
Вс16 далее связывается через свой амино-концевой домен POZ с тремя корепрессорами SMRT, NCoR и BCoR взаимоисключающим образом (Huynh and Bardwell, 1998; Huynh et al., 2000). Эти три корепрессора, которые дополнительно взаимодействуют с ферментом класса II — HDAC3 (Huynh et al., 2000), могут усиливать репрессию, опосредованную МТАЗ, тех же генов, служащих мишенями для Вс16, или сайленсировать другой набор генов в В-клетках зародышевого центра. Антигенная стимуляция высокоаффинных рецепторов Ig на В-клетках зародышевого центра сопровождается редукцией уровня белка Вс16. Активация рецептора, таким образом, ведет к фосфорилированию Вс16, индуцированному МАР-киназой, которое включает быструю деградацию белка Вс16 по убиквитин-протеосомному пути (Niu et al., 1998).
Падение уровня Вс16 смягчает репрессию гена Prdm1l, что приводит к увеличению экспрессии белка Blimp 1 и последующему развитию в плазматические клетки (рис. 21.10) (Shaffer et al., 2000; Calame et al., 2003). Blimp 1 контролирует множество аспектов дифференцировки плазматических клеток. Во-первых, Blimp 1 нацеливает глубинную транскрипционную программу дифференцировки В-клеток с помощью репрессирующего Рах5 (рис. 10) (Shaffer et al., 2002), который необходим для поддержания функции и идентичности В-клеток (Horcher et al., 2001; Mikkola et al., 2002). Во-вторых, с помощью даун-регуляции экспрессии других транскрипционных факторов (таких как Spi-B, EBF1, СИТА, Id3, Oct2, и OBF1) Blimp 1 косвенно заканчивает транскрипцию генов, которые кодируют белки, необходимые для сигналинга с рецептора антигена и для презентации антигена (Shaffer et al., 2002). В-третьих, чтобы обеспечить покоящееся состояние плазматических клеток, Blimp 1 напрямую репрессирует транскрипцию с-тус (Shaffer et al., 2002). В-четвертых, гены, несоответствующие линии, зарепрессированные в В-клетках при помоши Рах5, реактивируются после того, как в плазматических клетках произошла опосредованная Blimp 1 даун-регуляция экспрессии Рах5 (Delogu et al.,2006). Следовательно, подавляя остальные репрессоры, Blimp 1 может косвенно активировать экспрессию дополнительных генов с важными для плазматических клеток функциями. В-пятых, Blimp1 необходим для экспрессии секретируемых иммуноглобулинов (Calame et al., 2003), которые накапливаются в эндоплазматическом ретикулуме, активируя тем самым экспрессию ХВР1, как часть реакции на развернутый белок. Транскрипционный фактор ХВР1 регулирует секрецию антител, и, таким образом, он важен для дифференцировки плазматических клеток (Reimold et al., 2001; Shaffer et al., 2004).
Интересно, что Blimp 1 также является ключевым детерминантом спецификации примордиальных зародышевых клеток на ранних стадиях эмбриогенеза, как это обсуждается в главе 20. Механизм Blimp 1-опосредованной репрессии в развивающихся примордиальных зародышевых и плазматических клетках в основном неясен. Похоже, однако, что Blimp 1 использует в плазматических клетках те же принципы репрессии, что и в фибробластах, где PRDI-BF1, человеческий ортолог мышиного Blimp 1, участвует в постиндукционной репрессии гена p-интерферона (IFNB1) во время вирусной инфекции (Keller and Maniatis, 1991). Несколько механизмов отвечают за репрессию гена IFNB1, опосредованную PRDI-BF1. Присоединение PRDI-BF1 способно переместить активаторы транскрипции с промотора IFNB1(Keller and Maniatis, 1991). Кроме того, PRDI-BF1 взаимодействует с корепрессорами белкового семейства Groucho, которое использует деацетилазы гистонов как часть своего репрессионного механизма (Ren et al., 1999). Дальнейший сайленсинг достигается через ассоциацию PRDI-BF1 с белком G9a (Gyory et al., 2004), который принадлежит подсемейству метилтрансфераз гистонов со специфичностью к лизину 9 гистона H3 (Tachibana et al., 2002). В отличие от Suv39hl, который использует H3K9me3 для построения транскипционно репрессивной среды в центромерном гетерохроматине (Peters et al., 2001), G9a вносит свой вклад в H3K9me2 и генный сайленсинг в эухроматиновых участках (Tachibana et al., 2002). Каталитическая активность G9a требуется для подавления функции PRDI-BF1, так как каталитически неактивный белок G9a аннулирует ингибирующее влияние PRDI-BF1 на транскрипцию IFNB1 (Gyory et al., 2004). Далее делеция домена, взаимодействующего с G9a, предотвращает метилирование H3K9 и транскрипционный сайленсинг посредством PRDI-BF1 (Gyory et al., 2004). В свете этих данных вероятно, что метилирование гистонов, опосредованное G9a, является необходимым механизмом, с помощью которого Blimp 1 генерирует стабильный паттерн экспрессии генов в плазматических клетках. Интересно, что белок Blimp 1 также содержит домен SET подсемейства PR (RIZ). Предположили, что домен SET родственного белка RIZ1 (Prdm2) участвует в супрессии опухоли и метилировании гистона H3 по лизину 9 (Kim et al., 2003). Следовательно, остается проверить, вносит ли также домен SET белка Blimp 1 свой вклад в репрессию гена в процессе дифференцировки плазматических клеток.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК