2. Компенсация дозы связана с модификациями хроматина
Присутствие комплекса MSL на Х-хромосоме у самцов коррелирует с присутствием специфической изоформы гистона Н4, ацетилированной по лизину 16 ((Tumer et al., 1992; Bone et al., 1994). У дрожжей было показано, что эта конкретная ковалентная модификация гистона Н играет ключевую роль в поддержании границы между «молчащим» хроматином и активным хроматином: утрата функции Sas2, ацетилтрансферазы гистонов (HAT), отвечающей за H4K16ас, делает возможным распространение теломерного гетерохроматина в соседний субтеломерный хроматин (Suka et al., 2002; дополнительные детали см. в главе 4). Обнаружили, что у Drosophila Х-хромосома по своей длине сильно обогащена H4K16ас. Недавние структурные исследования показали, что ключевое межнуклеосомное взаимодействие может происходить между кислотным «пятном» (patch) гистонового димера H2A-H2B на одной нуклеосоме и положительно заряженным сегментом «хвоста» гистона Н4 (остатки 16–26), отходящего от соседней нуклеосомы (Schalch et al., 2005). Когда лизин 16 специфически ацетилирован, его положительный заряд становится нейтральным, позволяя предполагать, что ослабление репрессивной межнуклеосомной структуры могло бы играть ключевую роль в компенсации дозы.
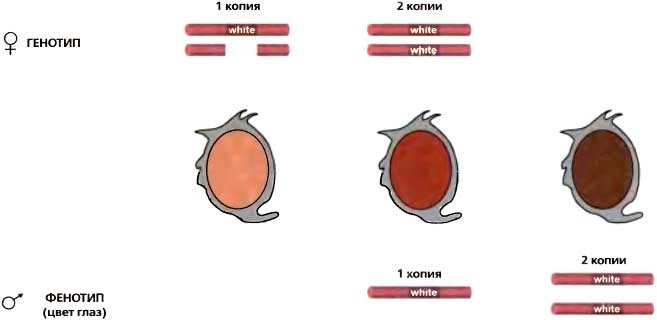
Рис. 16.2. Схематическое изображение результатов, которые привели Г. Дж. Меллера к формулировке гипотезы о компенсации дозы
Мутантная аллель (wa) сцепленного с X гена white является гипоморфом и делает возможным лишь частичный синтез глазного пигмента; ее присутствие на Х-хромосомах показано более темным прямоугольником. Уровень пигментации прямо пропорционален дозе аллели wa у каждого пола; тем не менее, самцы с одной дозой и самки с двумя дозами имеют сравнимые количества пигмента благодаря компенсации дозы
Ни один из первоначально идентифицированных факторов, участвующих в компенсации дозы, не обнаруживал характерных признаков HAT. Поскольку все предшествовавшие поиски мутантов были сконцентрированы на скрининге главных аутосом, был проведен новый поиск сцепленных с X специфичных для самцов летальных мутаций, и был идентифицирован новый ген, males absent on the first (mof) (Hilfiker et al., 1997). Рекомбинантный белок, кодируемый mofi является HAT, специфически ацетилирующей гистон Н4 по лизину 16 (Akhtar and Becker, 2000); он является интегральной частью комплекса MSL и однозначно отвечает за эту изоформу Н4 на Х-хромосоме самцов (Smith et al., 2000). MOF является членом подсемейства в семействе HATs, обозначаемом как MYST. Это подсемейство, характеризующееся присутствием хромодомена, можно далее подразделить на ферменты, которые специфически аиетилируют H4K16 in vivo (MOF и MOF человека; Smith et al., 2005) и такие ферменты, как Esal (essential SAS-related acetyltransferase 1 protein) у дрожжей, которые ацетилируют все четыре терминальных лизина в Н4 (Smith et al., 1998). Еще один член семейства MYST, SAS2, специфически ацетилирует H4K16 у дрожжей, но не имеет хромодомена.
В то же самое время, когда был открыт и охарактеризован MOF, были установлены каталитические свойства MLE, другой субъединицы с предполагаемой ферментативной активностью. Оказалось, что MLE обнаруживает in vitro активности РНК/ДНК-геликазы, аденозинтрифосфатазы (АТФазы) и связывания с однонитевой HYR|ssDNA (Lee et al., 1997), предрекая потенциальную роль РНК в функции MSL. Некоторые мультибелковые комплексы, взаимодействующие с хроматином для контроля скорости транскрипции эухроматиновых генов, используют гидролиз АТФ для изменения нуклеосомной конформации. За гидролиз АТФ отвечает семейство белков, содержащих геликазный домен (Sif, 2004); хотя это семейство может и не выполнять ту же самую функцию в комплексе MSL, оно представлено MLE. Ортологи MLE, в число которых входит РНК-геликаза А человека (RHA), принадлежат к подсемейству РНК-геликаз DEXH и характеризуются приобретением новых доменов (Kuroda et al., 1991) и консервативного аминотерминального участка длиной ~350 аминокислот (Pannuti and Lucchesi, 2000). MLE может осуществлять свою функцию в компенсации дозы скорее путем изменения структуры РНК, а не помогая в ремоделинге хроматина.
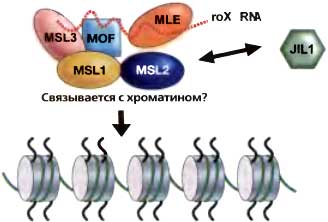
Рис. 16.3. Схема, иллюстррующая различные компоненты комплекса MSL
В число известных функций компонентов MSL входит ацетилирование гистона по H4K16 с помощью MOF, MLE обладает АТФазной и РНК/ДНК-геликазной активностью, a JIL-1 фосфорилирует гистон H3. Неясно, является ли JIL-1 субъединицей этого комплекса
Специфическая роль остальных компонентов комплекса MSL не вполне понятна. MSL3, субъединица комплекса MSL, характеризующаяся присутствием неканонического хромодомена и домена «chromoshadow» (Aasland and Stewart, 1995; Koonin et al., 1995), является членом семейства белков, которые могли совместно эволюировать с HATs, несущими хромодомен (Pannuti and Lucchesi, 2000). У дрожжей член этого семейства, Eaf3 (Esal-associated factor-3 protein), обнаружен в комплексе NuA4 с энзимом Esal группы MYST (Eisen et al., 2001). У Drosophila мультибелковый комплекс Tip60 включает MRG15, паралог MSL3 (Kusch et al., 2004). У человека MRG15 связан с MOF в комплексе MAF2 (Pardo et al., 2002). Особый интерес представляет существование у человека еще одного комплекса, родственного комплексу MSL и включающего человеческие гомологи MOF, MSL1, MSL2 и MSL3. Этот комплекс, специфически ацетилирующий H4K16 гистонов и отвечающий за большую часть этой изоформы гистонов в клетках человека, может включать одну из трех разных версий дрозофил иного гомолога MSL3, кодируемого двумя разными генами (Smith et al., 2005).
У Drosophila MSL1 и MSL2, как оказалось, опосредуют связывание комплекса MSL с хроматином (Kelley et al., 1995; Copps et al., 1998; Gu et al., 1998). Ни один из этих белков не содержит какой-либо поддающийся идентификации домен, связывающийся с ДНК, и «нацеливание» на хроматин, как оказалось, требует их ассоциации. MSL1 взаимодействует с доменом «RING finger» VSL2 через аминотерминальный домен типа coiled-coil (Copps et al., 1998; Scott et al., 2000) и с MSL3 и MOF через соседние консервативные карбокситерминальные домены (Morales et al., 2004). Ассоциация MSL2 с Х-хромосомой оказывается замечательно стабильной (Straub et al., 2005с). О гомологах MSL1 и MSL2 у человека сообщил Мартин (Martin, 2003). Поскольку у Drosophila MSL1 и MSL2 отвечают за ассоциацию комплекса MSL с Х-хромосомой, есть смысл пофантазировать, что hMSLl и hMSL2 могут играть роль в «нацеливании» комплекса MSL человека на сайты его действия.
Вполне вероятно, что кроме специфичных для самца факторов некоторые общие факторы, участвующие в организации хроматина и транскрипции у обоих полов, участвуют и в компенсации дозы JIL-1, тандемная киназа, обнаруживается на всех хромосомах и у самцов, и у самок, но ее концентрация выше на Х-хромосоме самцов. Эта повышенная концентрация зависит от комплекса MSL. JIL-1 опосредует фосфорилирование гистона H3 и поддерживает открытую структуру хроматина в транскрипционно активных районах генома (Jin et al., 1999; Wang et al., 2001); тем не менее, еще предстоит определить, играет ли он специфическую или общую роль в компенсации дозы. Недавно было обнаружено, что ядерные белки, в том числе нуклеопорины и субъединицы экзосомного комплекса иммунопреципитируются совместно с некоторыми MSL (Mendjou et al, 2006). Роль, которую эти белки могут играть в компенсации дозы, не определена.
Активность этого комплекса, должно быть, развилась для контроля предсуществовавших групп генов, каждая с их собственными специфическими регуляторными сигналами и внутренне присущими уровнями экспрессии. В пользу того, что комплекс MSL может «нацеливаться» на активные гены, говорит следующее наблюдение: связывание эктопического MSL появляется в регулируемых трансгенах, вставленных в X, только после индукции экспрессии (рис. 16.4) (Sass et al., 2003). На каком этапе общая транскрипция могла бы увеличиваться (be up-regulated) до двукратного уровня? У самцов Drosophila H4K16ас не ограничен промоторным участком компенсированных генов, сцепленных с X; скорее, он обнаруживается по всей длине сцепленных с X транскрипционных единиц, на которые «нацелен» комплекс MSL, с относительно скромными уровнями ацетилирования в промоторных участках и высокими уровнями в средних участках и (или) 3’-концах (Smith et al., 2001). Такое распределение ацетилирования заставляет предполагать, что комплекс MSL функционирует, чтобы увеличить экспрессию сцепленных с X генов, путем облегчения транскрипционной элонгации и, возможно, рециклирования РНК-полимеразы, а не непосредственного увеличения доступности промотора.
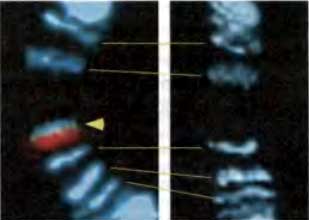
Рис. 16.4. Комплекс MSL «нацеливается» на активированные гены
Конструкт, содержащий промотор под контролем trans-активатора GAL4 был вставлен в сайт, в норме лишенный комплекса MSL в хромосомах личиночной слюнной железы (правая часть рисунка). Когда ген, экспрессирующий GAL4, вводится в геном (левая часть рисунка), trans-активатор связывается с конструктом (красный цвет) и рекрутирует комплекс MSL (зеленый цвет) (перепечатано, с любезного разрешения, из: Sass et al., 2003 [©National Academy of Sciences]
Для объяснения функции комплекса MSL была предложена альтернативная гипотеза (Birchler et al., 2003). Эта гипотеза основывается на представлении, что у самок активность всех хромосом устанавливается, наряду с другими факторами, однородным распределением MOF. У самцов, в силу отсутствия одной Х-хромосомы, для аутосом и для единственной Х-хромосомы доступна более высокая концентрация MOF и неизвестных факторов, что приводит к более высоким уровням их активности; комплекс MSL образуется и рекрутируется к Х-хромосоме для того, чтобы изолировать факторы гипертранскрипции, в том числе MOF, от аутосом. В этой модели главная роль комплекса MSL заключается в том, чтобы даун-регулировать аутосомные гены, а не в том, чтобы ап-регулировать гены, сцепленные с X. Однако этой гипотезе противоречат два независимых исследования; в них показано, что утрата «нацеливания» комплекса MSL клетках культуры ткани самца уменьшали транскрипцию генов на Х-хромосоме, в то время как уровень экспрессии аутосомных генов не изменялся (Hamada et al., 2005; Straub et al., 2005b). Аналогичные результаты были недавно опубликованы относительно экспрессии сцепленного с X гена в мужской зародышевой линии (Gupta et al., 2006).
Сборка хроматина недавно была подразделена на связанную с репликацией и не зависимую от репликации откладку [deposition] нуклеосом. Последняя происходит в транскрипционно активных районах хроматина и включает замещение гистона H3 вариантом H3.З (глава 13). С этим наблюдением согласуется тот факт, что скорость включения гистона H3.З в Х-хромосому в клетках самца повышена по отношению к аутосомам (Mito et al., 2005).
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК