4.1. Метилирование лизинов
Тот факт, что лизиновые остатки в гистонах метилированы, был известен многие десятилетия. Однако биологическое значение этой модификации стало высвечиваться лишь недавно, после идентификации первой метилтрансферазы лизинов, использующей гистоны в качестве своего субстрата (Rea et al., 2000). В настоящее время идентифицировано большее количество лизиновых метилтрансфераз (HKMTs), и определены сайты, модифицируемые ими на гистонах (Martin and Zhang, 2005). Все эти ферменты, за исключением Dot 1, имеют общий домен SET, который содержит каталитически активный сайт и делает возможным связывание с S-аденозил-L-метиониновым кофактором.
Из большого числа известных метилированных сайтов к сегодняшнему дню хорошо охарактеризованы шесть; пять на H3 (К4, К9, К27, К36, К79) и один на Н4 (К20). Метилирование по H3K4, H3K36 и H3K79 в целом было связано с активацией транскрипции, а остальные варианты — с репрессией (табл. 10.1). Кроме того, два из этих сайтов — H3K79me и H4K20me — участвуют, как считается, в процессе репарации ДНК. Были идентифицированы специфические белки-связки, распознающие каждый из шести охарактеризованных сайтов метилирования (рис. 10.4). Эти белки имеют домен узнавания лизина, относящийся к одному из трех разных типов: хромо, тюдор и PHD-повтор. Ниже каждая из этих охарактеризованных модификаций обсуждается более детально.
Метилирование H3K4
Метилирование H3K4 связано с эухроматином, а именно с генами, которые активны или должны стать активными. Демонстрация того, что метилирование H3K4 коррелирует с активным хроматином, была получена при анализе локуса куриного β-глобина и локусов типа спаривания почкующихся дрожжей (Litt et al., 2001; Noma et al., 2001). ChlPs с использованием антител, специфичных к метилированным H3K4, показали, что островки модифицированных гистонов метят активные гены. Последующая работа на дрожжах показала, что в процессе активной транскрипции появляется триметильное состояние (H3K4me3) (Santos-Rosa etal., 2002).
У дрожжей во время активации транскрипции модификация H3K4me3 наблюдается на 5’-концах генов.
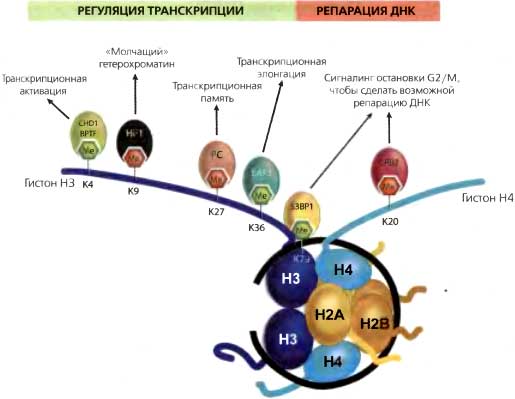
Рис. 10.4. Сайты метилирования гистонов, их белковые связки и функциональная роль в геномных процессах
Метилирование гистонов происходит по лизиновым остаткам в гистонах НЗ и Н4. Некоторые метилированные остатки лизина ассоциированы с активацией транскрипции (зеленый флажок Me), тогда как другие участвуют в репрессивных процессах (красный флажок Me). Показаны белки, связывающиеся с определенными метилированными остатками лизина
Полагают, что за эту метку отвечают три компонента транскрипционной машины. Во-первых, RNA pol II, фосфорилированная по Ser-5 карбокситерминального домена (CTD), может рекрутировать Setl HKMT, которая метилирует H3K4 поблизости от промоторов (рис. 10.5). Такое фосфорилирование в норме высвобождает RNApol II из комлекса инициации транскрипции в комплекс ранней элонгации (часто называемый promoter clearance или escape). Второй компонент, рекрутирующий H3K4me3, это комплекс RAF, который регулирует различные этапы метаболизма РНК и также взаимодействует с Setl. Третьим компонентом, важным для установления H3K4me3, является моноубиквитилирование Н2В по Lys-123 (H2BK123ub1 или H2BK120ub1 у человека; обсуждается ниже, в разделе 6). Что остается неясным, так это вопрос о том, какие процессы транскрипционной элонгации контролирует H3K4me3 (Hampsey and Reiberg, 2003); однако факторы, специфически связывающиеся с метилированными H3K4me3, начинают выявлять его роль.
В механистическом плане метилирование H3K4 может приводить к рекрутированию таких специфических факторов, как белок CHD1, который, как было показано, связывается с H3K4me2 и me3 (рис. 10.4), и комплекс NURF, который, как известно, мобилизует нуклеосомы в активных генах у Drosophila. Домены, опосредующие связь с метилированными H3K4, являются тандемным набором хромодоменов в Chdl (Sims et al., 2006) и «пальцем» PHD в NURF (Li et al., 2006). Среди других белков, рекрутируемых метилированием H3K4, — АТФ-аза ISWI, которая связывается непрямым образом, через посредство другого белка (белков). Напротив, имеются данные, что репрессорный комплекс NuRD у млекопитающих больше не связывается с метилированными «хвостами» H3K4 (D.Y. Lee et al., 2005; Martin and Zhang, 2005).
Метилирование по H3K4, по-видимому, взаимодействует с другими модификациями. Например, метилирование H3K9 HKMT SUV39H in vitro предотвращается, если H3K4 метилирован и H3S10 фосфорилирован. Это вполне может быть способом закрытия репрессивной модификации H3K9 на активно транскрибируемых генах. При более сложной форме взаимодействия типа «trans-tail» моноубиквитинилирование H2BK123 влияет на уровни H3K4me3. Как это происходит — неясно, но одно из предположений заключается в том, что комплекс Setl не может триметилировать H3K4, если нуклеосома (нуклеосомы) не находится в определенном конформационном состоянии, которое определяется убиквитилированием Н2В (Zhang and Reinberg, 2001; D.Y. Lee et al., 2005).
Белок Setl/MLL/ALLl/HRX, который является гомологом Setl у человека, может рекрутироваться к промоторам гена НОХ. Другая H3K4 HKMT, SMYD3, оказалась сцепленной с транскрипционной активацией. Метилирование с помощью SMYD3 также было связано с индукцией клеточной пролиферации. В самом деле, ограниченный анализ человеческих энзимов, метилирующих H3K4, позволяет предполагать их участие в генезе рака (D.Y. Lee et al., 2005).
Метилирование H3K36
Полученные данные привели к предположению, что метилирование H3K36 необходимо для эффективной элонгации RNA pol II через колирующий участок. Кодирующий район активных генов очень обогащен этой модификацией в противоположность 5’-локализации метилирования H3K4. Белок Set2 является HKMT, способной метилировать H3K36 Фермент Set2 связывается предпочтительно с RNA pol II, которая была фосфорилирована по Ser-2 в пределах его CTD (рис. 10.5). Эта форма RNA pol II, которая, между прочим, отличается от фосфорилированного состояния, связанного с очисткой промотора, имеет тенденцию аккумулироваться в транскрибируемых районах так же, как на 3’-концах генов. Это согласуется с тем, что H3KЗбme3 достигает пика на 3’-концах генов, которые активно транскрибируются. Рекрутирование Set2 к активным генам требует также компонентов комплекса РАЕ, как в случае рекрутирования Setl. Однако моноубиквитилирование Н2В играет негативную репрессивную роль в метилировании H3K36 (Zhang and Reinberg, 2001; Martin and Zhang, 2005). Действительно, комплекс SAGA, рекрутируемый к транскрибируемым генам у дрожжей, содержит Ubp8, деубиквиназу, которая специфична к H2BK123. Дальнейшие исследования позволили предположить, что убиквитилирование и деубиквитилирование H2BK123 являются активным процессом в ходе транскрипционной элонгации.
Продвижение RNA pol II через кодирующие участки требует ацетилирования нуклеосом. Транскрипционное регулирование также нужно для подавления неправильной внутренней инициации транскрипции с криптических стартовых сайтов, которые встречаются внутри кодирующих районов. Чтобы подавить этот процесс, метилирование по H3K36 с помощью Set2 создает сайт узнавания для белка EAF3 через его хромодомен, который в свою очередь опосредует рекрутирование комплекса Rpd3S HDAC. Деацетилазная активность Rpd3S удаляет затем ацетилирование гистонов, связанное с элонгацией, супрессируя таким образом внутреннюю инициацию (Carrozza et al., 2005; Joshi and Struhl, 2005; Keogh et al., 2005). Метилирование H3K36 также оказалось на гораздо более низком уровне в промоторах индуцибельных генов, но в этом случае его влияние оказывается репрессивным (Zhang and Reinberg, 2001).
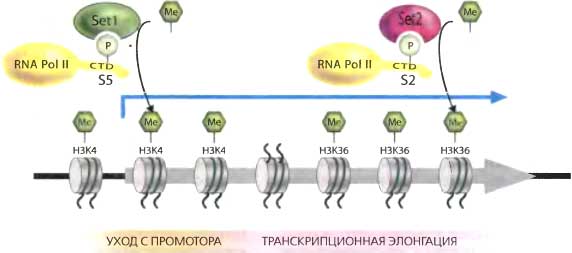
Рис. 10.5. Роль метилирования лизинов гистонов в транскрипционной элонгации
РНК-полимераза II рекрутирует разные типы HKMTs в зависимости от состояния фосфорилирования его карбокситерминального домена (CTD) РНК-полимераза II активируется для инициации транскрипции поблизости от промотора, когда Ser-5 фосфорилирован. Это рекрутирует Setl HKMT для метилирования H3K4. Фосфорилирование Ser-2 происходит в ходе транскрипционной элонгации, побуждая к метилированию H3K36 в результате рекрутирования Set2 HKMT к хроматиновой матрице
Метилирование по H3K79 является необычным, потому что эта модификация лежит в коре нуклеосомы, а не в «хвосте», где находится большинство других охарактеризованных сайтов метилирования Глобальный анализ показал, что H3K79 метилируется в эухроматиновых районах дрожжей и ассоциируется главным образом с кодирующим участком активных генов. Ограниченный анализ у высших эукариот демонстрирует такой же профиль.
Энзим млекопитающих, метилирующий H3K79, hDOTIL, как было показано, опосредует лейкемогенные функции белка слияния MLL-AF10. Однако до сего дня не обнаружен белок, который связывается с H3K79me и связывает его с транскрипционными событиями. Единственные данные механистического плана о том. как метилирование H3K79 функционирует в активации транскрипции, были получены в работе с почкующимися дрожжами. Эта работа показывает, что данная модификация каким-то образом лимитирует такие репрессивные белки, как Sir2 и Sir3, в эухроматине, внося таким образом свой вклад в регулирование и поддержание «молчащего» гетерохроматина за счет усиления их концентрации в репрессивных участках хроматина. Другой функцией, приписываемой H3K79 HKMT Dotl у дрожжей, является опосредование «контрольной точки» репарации ДНК. В соответствии с этим последним фактом в клетках человека был идентифицирован белок Р53ВР1, который может связываться с метилированным H3K79 и играет роль в функции «контрольной точки» в репарации ДНК (Martin and Zhang, 2005).
Метилирование H3K9
Этот тип метилирования является сегодня наиболее изученной модификацией гистонов, главным образом
потому, что энзим, метилирующий H3K9, — SUV39H1 — был первой идентифицированной HKMT (Rea et al., 2000). Ее гомологу Drosophila, Su(var)3-9, первоначально был идентифицирован как супрессор мозаичности, что указывало на то, что он участвует в механизме сайленсинга эффекта положения мозаичного типа (PEV), который связан с распространением гетерохроматина в соседние эухроматиновые гены (дополнительные детали см. в главе 5). Осознание того, что SUV39H1 по нуклеотидной последовательности сходен с метилтрансферазой растений, субстратом для которой является Rubisco, привело к идентификации домена Suv39 SET как каталитического домена, способного метилировать H3K9.
Был достигнут прогресс в определении функции метилирования H3K9 в формировании перицентромерного гетерохроматина, что широко обсуждается также и в других главах (об исследованиях на Drosophila см. главу 5, об исследованиях на S. pombe см. главу 6 и об исследованиях по опосредованному RNAi формированию гетерохроматина см. главу 8). Эти результаты получены в основном в исследованиях на дробянковых дрожжах и млекопитающих, где гетерохроматиновые структуры, как полагают, достаточно консервативны (но обратите внимание на то, что у почкующихся дрожжей метилирование H3K9 не было обнаружено). Суммируя, можно сказать, что первый этап нашего понимания возник на основе исследований факторов, участвующих в установлении гетерохроматина. В их число входит кооперация двух белков: SUV39H (или Clr4 у дробянковых дрожжей) и его партнер по связыванию НР1 (или Swi6 у дробянковых дрожжей [Nakayamaet al., 2001; Nomaet al., 2001]). Была предложена модель, в которой SUV39H метилирует H3K9, создавая платформу для связывания НР1 через его хромодомен (Bannister et al., 2001; Lach-ner et al., 2001). Коль скоро HP1 связался, он может распространяться на соседние нуклеосомы за счет его ассоциации с SUV39Y. который далее катализирует метилирование соседних гистонов (Nakayama et al., 2001). Кроме того, НР1 ассоциируется сам с собой через домен «chromoshadow», облегчая распространение гетерохроматина. Однако каким образом распространение НР1 диктует формирование плотно упакованных гетерохроматиновых структур остается неизвестным.
Вышеуказанная модель предсказывает, что должен быть специальный механизм основанного на гетерохроматине рекрутирования для фермента SUV39H HKMT. прежде чем станет возможным распространение НР1. Ключ к разгадкё того, что бы это могло быть, был получен в серии экспериментов на дробянковых дрожжах, которые продемонстрировали связь между формированием гетерохроматина и образованием коротких интерферирующих РНК (siRNAs) (Hall et al., 2002; Volpe et al., 2002). Эти РНК возникают в результате двунаправленной транскрипции центромерных повторов, которые пропессируются в siRNAs ферментом dicer. Эти siRNAs упаковываются затем в комплекс RITS, который содержит обладающий хромодоменом белок, Chp1, который связывается с метилированным H3K9. Таким образом, «нацеливание» комплекса RITS на хроматин образует начальную стадию формирования гетерохроматина.
Распространение и поддержание гетерохроматина на участке, 20 т.п.н., как описано выше, требует метилирования H3K9 гистона Clr4 HKMT и связывания Swi6 с метилированным по H3K9 хроматином (Martin and Zhang, 2005; дополнительные детали см. в главе 8).
Представление о взаимозависимости разных репрессивных эпигенетических механизмов возникло из исследований, проводившихся вначале на Neurospora crassa. но также и на растениях, особенно заметно продемонстрировавших связь между метилированием H3K9 и процессом метилирования ДНК (главы 6 и 8). Метилирование H3K9 необходимо для того, чтобы имело место метилирование ДНК; по-видимому, действует и реципрокная связь, когда метилирование H3K9 зависит от метилирования ДНК. Более того, недавние исследования на раковых клетках млекопитающих, у которых нет ДНК-метилтрансферазных ферментов (Dnmts), показывают сниженные уровни метилирования H3K9, и это можно приписать тому, что связывющийся с метил-CpG белок 1 (MBD1, methyl-CpG-binding protein 1) ассоциируется с H3K9 HKMT SETDB1 (Zhang and Reinberg, 2001; Martin and Zhang, 2005; дополнительные детали см. в главе 18).
Метилирование по H3K9 функционирует также в репрессии эухроматиновых генов ChlPs выявляют это метилирование в промоторе генов млекопитающих, когда эти гены «молчат». Механизм этой репрессии в эухроматиновых сайтах, по-видимому, слегка отличается от механизмов, встречающихся в гетерохроматиновых районах. Репрессорный белок RB предъявляет SU-V39H1 HKMT и НР1 таким эухроматиновым генам, как ген регулируемого E2F циклина Е. Однако, в отличие от гетерохроматина, заполнение НР1, по-видимому, ограничено одной или немногими нуклеосомами вокруг сайта инициации, даже несмотря на то, что метилирование H3K9 происходит и в других местах на промоторе. В другом примере репрессор КАР1 приносит ESET/SET-DB1 HKMT к промотору генов, регулируемых КАР1, и сайленсирует транскрипцию метилированием H3K9 и рекрутированием НР1. То, что НР1 специфически ограничены этими эухроматиновыми промоторами, и предотвращение распространения позволяют предполагать для НР1 наличие отдельного механизма действия по отношению к его гетерохроматиновой роли. Один возможный способ действия НР1, получивший некоторую поддержку, заключается в том, что он действует как якорь, закрепленный в богатых гетерохроматином ядерных компартментах. В ходе репрессии эухроматиновых генов наблюдали движения, показывающие, что «молчащий» ген смешается в гетерохроматиновый район, и это перемещение зависит от гамма-изоформы НР1 (Martin and Zhang, 2005).
Формирование гетерохроматина в теломерах, хотя и связано с НР1 и метилированием H3K9, отличается от вышеупомянутых перицентромерных и «молчащих» эухроматиновых районов. У Drosophila НР1 не рекрутируется к теломерным концам через его хромо- и «chromoshadow»-домен, и метилирование H3K9 катализируется неизвестной HKMT. У млекопитающих другие гомологи НР1, СВХ1, СВХЗ и СВХ5 участвуют в связывании с метилированным H3K9, преобразованным белками SUV39H1 и SUV39H2 для формирования репрессивных хроматиновых доменов на хромосомных концах (дополнительные детали см. в главе 14).
Метилирование H3K27
Метилирование H3K27 является репрессивной модификацией, обнаруживаемой в клетке в трех разных местах:
(1) в эухроматиновых генных локусах, преимущественно там, где имеются реагирующие элементы Polycomb (PREs, Polycomb Response Elements) в случае Drosophila,
(2) в перицентромерном гетерохроматине и (3) в неактивной Х-хромосоме у млекопитающих.
В клетках человека ферментом, опосредующим метилирование H3K27, является EZH2 — гомолог белка ENHANCER OF ZESTE [E(Z)] у Drosophila. Этот энзим EZH2 обнаруживается в ряде отдельных репрессивных комплексов Polycomb (PRCs), которые ассоциируются со специфичными репрессивными элементами Polycomb-ДНК в промоторах у Drosophila (глава 11). Что «нацеливает» содержащие EZH2 комплексы на специфические гены у млекопитающих — неизвестно, поскольку репрессивные элементы Polycomb не были идентифицированы. Однако «нацеливание» этих EZI-12-комплексов может быть опосредовано рядом транскрипционных факторов, в том числе GAGA и MYC. Механизмы репрессии, осуществляемой EZH2, включают метилирование H3K27 и рекрутирование белка Polycomb (Рс) к этому модифицированному сайту (как в модели 3 на рис. 10.1). Важным аспектом пути, ведущего к метилированию H3K27, является предположение о его роли в раковых заболеваниях. В ряде раковых тканей, в том числе при раке груди и простаты, обнаружена сверхэкспрессия H3K27 HKMT EZH2 (Martin and Zhang, 2005).
Метилирование H4K20
Очень мало что известно, в механистическом плане, о роли этой модификации в контроле транскрипции. Что очевидно, так это то, что в перицентромерном гетерохроматине присутствуют H4K20me2 и H4K20me3 и что ферментами HKMT, опосредующими эти модификации, являются SUV4-20H1 и SUV4-20H2. Для метилирования H4K20, по-видимому, требуется метилирование H3K9.
Еще одним ферментом, который может монометилировать H4K20 у высших эукариот, является PR-Set7, для которого предполагается участие в митотических событиях. Наконец, имеются функциональные доказательства того, что у почкующихся дрожжей метилирование H4K20 сцеплено с репарацией ДНК через связывание белка «контрольной точки» повреждений ДНК, CrB2 (Martin and Zhang).
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК