6. Как формирование гетерохроматина «нацеливается» у Drosophila?
Хотя мы многое узнали о механистических аспектах и биохимии структуры гетерохроматина, как это описано выше, остается открытым вопрос о том, каким образом формирование гетерохроматина «нацеливается» на избранные районы генома в его нормальной конфигурации. Все гетерохроматиновые домены обладают некоторыми общими чертами, и две такие особенности признаны существенными входными сигналами [inputs] для сборки гетерохроматина на данной нуклеотидной последовательности ДНК: положение локуса относительно пространственно обособленных [distinct] субдоменов гетерохроматина в ядре и присутствие повторяющейся ДНК
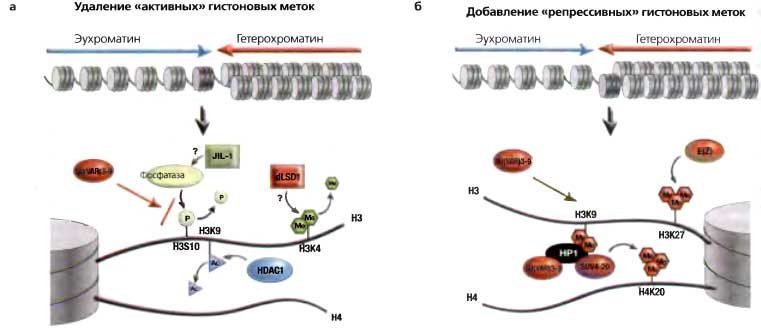
Рис. 5.6. Переход из эухроматинового состояния в гетерохроматиновое состояние требует ряда изменений в модификациях гистонов
(а) Активные гены маркированы H3K4me2 и me3; эта метка, если присутствует, предположительно должна быть удалена LSD1 (у Drosophila пока еще не охарактеризован). В эухроматине НЗК9 в норме апетилирован; эта метка должна быть удалена деацетилазой гистонов, HDAC1. Фосфорилирование H3S10 может интерферировать с метилированием НЗК9; дефосфорилирование, по-видимому, происходит с участием фосфатазы, «нацеливаемой» взаимодействием с карбоксильным концом киназы JIL1 Эти переходы создают обстановку для приобретения модификаций, связанных с сайленсингом (показано на б), в том числе метилирования НЗК9 белком SU(VAR)3-9, связывания НР1 и последующего метилирования Н4К20 белком SUV4-20, ферментом, рекрутируемым НР1. Может также происходить метилирование НЗК27 энзимом E(Z)
В целом гетерохроматиновые массы видны на периферии ядра и вокруг ядрышка. У эмбрионов Drosophila эта тенденция выражена еще более отчетливо. Гетерохроматиновые массы впервые видны в раннем эмбриогнезе, когда ядра перемещаются к периферии яйца. Раннее развитие у Drosophila является синцитиальным вплоть до 14-го цикла ядерных делений, когда образуются клеточные стенки между ядрами, и образуется типичная бластула (шарик из клеток). Гетерохромати новый материал (центромеры, четвертая хромосома) концентрируется на одной стороне ядра, ориентированной в сторону внешней поверхности яйца (Foe and Alberts, 1985). Такое пространственное подразделение ядра сохраняется в ходе развития, приводя к концепции [the concept] гетерохроматиновых «компартментов» в ядре. Эти компартменты могут поддерживать высокую концентрацию факторов, необходимых для формирования гетерохроматина (таких как НР1 и HKMTs), и в то же время могут быть лишены факторов, необходимых для сборки эухроматина и экспрессии генов (таких как HATs и RNA pol II). Действительно, было показано, что близость к гетерохроматиновым массам, как по положению вдоль по длине хромосомы, так и в трех измерениях, является одним из факторов в PEV.
Было показано, что близость к массе центрического [centric] гетерохроматина влияет на мозаицизм как для эухроматиновых генов (примером которых является white; см. выше), так и для гетерохроматиновых генов (наиболее изученными примерами которых являются light и rolled). Можно наблюдать, что гетерохроматиновые гены, картированные в эти домены, обнаруживают мозаичность, когда перестройка помещает их в непосредственной близости от эухроматина; обычно они демонстрируют противоположную зависимость, требуя для полной экспрессии нормальных уровней HP 1 и показывая усиление мозаичности, когда количество НР1 мало.
Мозаицизм light зависит не только от его близости к эухроматину, но и от положения точки разрыва а именно от расстояния от гетерохроматина, измеряемого по длине хромосомного плеча (Wakimoto and Hearn 1990). Аналогичные данные были опубликованы для rolled. Исследования brown dominant (bwD), эухроматинового гена, мозаицизм экспрессии которого был индуцирован вставкой повторяющейся ДНК, показали, что сдвиг в степени близости этого локуса к центрическому гетерохроматину может приводить к усилению сайленсинга (если ближе) или подавлению сайленсинга (если дальше) (Henikoff et al., 1995). Аналогичным образом транслокация четвертой хромосомы, несушей репортер white, в дистальную половину хромосомного плеча 2L или 2R приводит к резкой утрате сайленсинга; в ядрах слюнных желез это коррелирует с изменением во внутриядерном расположении, вплоть до того, что часто оказываются занятыми сайты, удаленные от хромоцентра (Cryder-manetal., 1999а).
В недавнем исследовании с использованием микроскопии высокого разрешения изучали как активность гена (используя антитела, специфичные к продукту), так и ядерную локализацию репортера (используя FISH — fluorescence in situ hybridization) в одной и той же клетке в нормальных временных рамках экспрессии. Инверсия, вызывающая мозаицизм white, а также bwD и трансген lacZ с мозаичной экспрессией изучались в дифференцирующихся глазных дисках или в глазах взрослых мух. В этом исследовании обнаружили сильную корреляцию между положением репортерного гена в клеточном ядре по отношению к перицентромерному гетерохроматину и уровнем экспрессии, что говорило в пользу существования гетерохроматинового «компартмента» и корреляции между положением в этом компартменте и сайленсингом гена (Harmon and Sedat, 2005). Однако эта корреляция не является абсолютной. Это неудивительно, при том что исследования с репортером white указывают на присутствие как эухроматиновых, так и гетерохроматиновых доменов, чередующихся в маленькой четвертой хромосоме (которая всегда располагается вблизи массы перицентромерного гетерохроматина). Эти последние наблюдения указывают на другие локальные детерминанты, вносящие вклад в упаковку хроматина в той или в другой форме.
У D. melanogaster, согласно оценке по цитологическим критериям, одна треть генома является гетерохроматиновой. Сюда входят крупные блоки, которые фланкируют центромеры, более мелкие блоки, связанные с теломерами, вся Y-хромосома и большая часть маленькой четвертой хромосомы. Центромерные районы состоят из крупных (0,2—1 млн о.) блоков сателлитной ДНК, чередующихся с «островками» сложных нуклеотидных последовательностей, обычно мобильных элементов (Le et al., 1995). Эти районы, хотя и бедны генами, не лишены их вовсе; согласно современным оценкам, в перицентромерном гетерохроматине находятся несколько сотен генов (Hoskins et al., 2002). Теломеры Drosophila не содержат типичных повторов, обогащенных G, которые наблюдаются в других местах, но состоят из копий ретротранспозонов НеТ-А и TART. Ассоциированные с теломерами последовательности (TAS — telomere-associated sequences), блоки из повторов 102—103 нуклеотидов, обнаруживаются в проксимальном положении, и трансгенные репортеры white, вставленные в эти районы, демонстрируют мозаичный фенотип. Хотя Y-хромосома и несет гены для ряда факторов мужской фертильности, основная масса этой хромосомы составлена из сателлитной ДНК, и она остается конденсированной во всех клетках за исключением мужской зародышевой линии. Размеры маленькой четвертой хромосомы порядка 4,3 млн о., в том числе около 3 млн о., состоящих из сателлитной ДНК. Дистальные 1,2 млн о. могут считаться эухроматиновыми в том отношении, что они политенизированы в слюнной железе (см. рис. 5.4), но, судя по их поздней репликации, полному отсутствию в них меиотических обменов и по их связи с НР1, НР2 и H3K9me2, они, по-видимому, являются гетерохроматиновыми (рис. 5.4). Плотность фрагментов транспозонов в этом районе в шесть—семь раз выше, чем в эухроматиновых плечах, подобно участкам на границе между центрическим гетерохроматином и эухроматином на других хромосомах (Kaminker et al., 2002). Интересно, что в исследованиях четвертой хромосомы с помощью P-элемента с репортером white, обсуждавшегося выше (рис. 5.3а), обнаружили чередование как эухроматиновых доменов (приводящих к «красноглазому» фенотипу) так и гетерохроматиновых доменов (приводящих к мозаичному фенотипу) (Sun et al., 2004).
Эти данные заставляют предполагать присутствие локальных элементов в ДНК, способных управлять формированием гетерохроматина или эухроматина. Генетический скрининг на переключение фенотипа (с красной окраски на мозаичность и наоборот) показал, что локальные делеции или дупликации 5—80 т.о. ДНК, фланкирующей транспозонный репортер, могут приводить к утрате или приобретению мозаичности, указывая на наличие cis-действующих (на короткие расстояния) детерминантов сайленсинга (рис. 5.7). Этот сайленсинг зависит от НР1 и коррелирует с изменением в структуре хроматина, как показывает изменение в доступности для нуклеаз; все это указывает на сдвиг от эухроматинового к гетерохроматиновому состоянию. Данные по картированию в одном из районов четвертой хромосомы позволяют предполагать, что транспозон 1360 является мишенью для формирования гетерохроматина, и показывают, что, коль скоро формирование гетерохроматина начинается в диспергированных повторяющихся элементах, оно может распространяться вдоль по длине четвертой хромосомы примерно на 10 т.о. или пока не столкнется с конкуренцией со стороны эухроматинового детерминанта (Sun et al., 2004). Наблюдения, показывающие, что тандемные или инвертированные повторы репортерных Р- элементов приводят к формированию гетерохроматина и сайленсингу генов, также позволяют предполагать наличие действующих на короткие расстояния cis-активных детерминантов, связанных с числом копий (Dorer and Henikoff, 1994).
Такие cis-активные элементы в ДНК могли бы функционировать посредством сиквенс-специфичного связывания белка, способного включать формирование гетерохроматина Были идентифицированы белки, специфически связывающиеся с некоторыми из сателлитных ДНК (например, D1 — Aulner et al., 2002). Вывод о важности этих взаимодействий был сделан, исходя из влияния специфичных для сателлитной ДНК веществ, связывающихся с ДНК и способных подавлять PEV (Janssen et al., 2000). Однако данные, полученные на дрожжах и растениях (Elgin and Grewal, 2003; Matzke and Birchler, 2005; см. Главы 8 и 9), позволяют предложить другую модель, а именно, что некий основанный на RNAi механизм мог бы использоваться для «нацеливания» формирования гетерохроматина на повторяющиеся элементы. Работы из нескольких лабораторий показали, что система RNAi у Drosophila имеется и играет важную роль в регуляции в ходе развития посредством посттранскрипционного сайленсинга генов (PTGS). D. melanogaster обладает двумя генами, кодирующими белки DICER, и многочисленными генами (aubergine, AGO1, AGO2, spindle [известный также как homeless], vasa intronic gene [VIG], armitage, Fmr1), кодирующими компоненты или белки, необходимые для сборки индуцируемого РНК сайленсирующего комплекса (RISC) (Sontheimer, 2005). Участие этой системы предположили в PTGS повторяющихся последовательностей, особенно тандемно повторяющихся генов Stellate, нескольких ретротранспозонов и трансгенов Alcohol dehy-rogenase (Adh) и в транскрипционном сайленсинге (TGS) трансгенов Adh (Aravin et al., 2001; Pal-Bhadra et al., 2002). Пал-Бхадра с соавторами (Pal-Bhadra et al., 2004) обнаружили при прямом тестировании, что мутации вpiwi (член семейства домена PAZ) и homeless (DEAD-боксовая геликаза) подавляют PEV, связанный с тандемными порядками гена white, и что мутации в piwi, aubergine и homeless подавляют сайленсинг трансгена white P[hsp70-w] в перицентромерном гетерохроматине или четвертой хромосоме. Эта супрессия PEV была связана со значительным снижением уровня метилирования H3K9. Связанные с повторами малые интерферирующие РНК (rasiRNAs) были идентифицированы с 40 % известных мобильных элементов (включая 1360) и других повторяющихся последовательностей (Aravin et al., 2003).
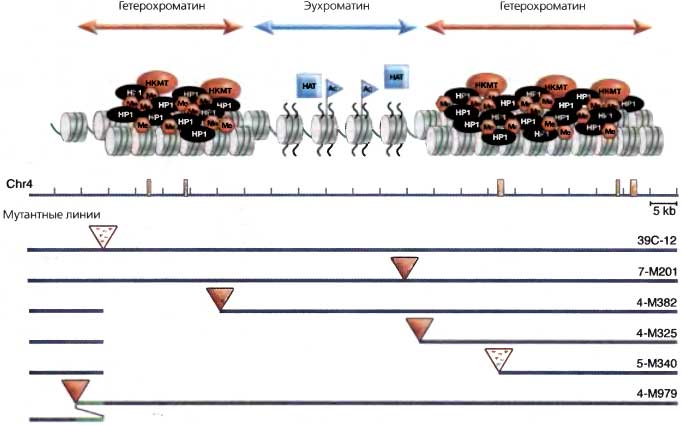
Рис. 5.7. Возможная модель гетерохроматинового «нацеливания»
dsRNA с повторяющихся последовательностей процессируется с помощью RISC и генерирует гипотетический «комплекс нацеливания», который управляет либо модификацией гистонов, либо ассоциацией с НР1 как начальным этапом в сборке гетерохроматина в сайте, идентифицированном малой ssRNA. Данные, полученные на четвертой хромосоме, позволяют предположить, что фрагменты ДНК-транспозона 1360 (оранжевые полосы) являются мишенью для формирования гетерохроматина: локальные делеции или дупликации, которые сдвигают положение репортера R-элемента (треугольник) в сторону от элемента 1360, ведут к утрате сайленсинга (красный треугольник обозначает красный глаз), тогда как близость к 1360 приводит к сайленсингу (треугольник с точками обозначает мозаичный глаз) (на основе данных Sun et al., 2004)
В совокупности эти обсуждавшиеся выше результаты заставляют предполагать, что формирование гетерохроматина может зависеть как от ядерной локализации (возможно, создающих богатый пул требующихся белков), так и от специфического «нацеливания» на основе RNAi-распознавания и процессинга двунитевой РНК с повторяющихся элементов, в особенности некоторых из ДНК-транспозонов. Такое «нацеливание» посредством RISC могло бы привлечь либо метилтрансферазу гистона H3, либо комплекс, включающий НР1 (либо и то, и другое) к сайту для включения процесса сборки, обсуждавшегося в разделе 4.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК