6. Молекулярная анатомия эпигенетически сайленсированных раковых генов
Гены, сайленсированные в неопластических клетках, важны для понимания инициации и дальнейшего поддержания рака. Они также служат великолепными моделями для понимания того, как может инициироваться и поддерживаться сайленсинг гена, и как упакован геном млекопитающих, чтобы облегчить доступ к участкам транскрипции и репрессии транскрипции. В свою очередь, понимание функции хроматина, на которой сосредоточено основное внимание во многих главах этой книги, облегчает наше понимание того, что может служить триггером для аберрантного сайленсинга генов при раке, и того, как компоненты этого сайленсинга поддерживают сопутствующую ему транскрипционную репрессию.
Работа нескольких лабораторий внесла свой вклад в текущее понимание конфигурации хроматина, который окружает гиперметилированные островки CpG в промоторах многочисленных генов, аберрантно сайленсированных в раковых клетках. Эти исследования также показали, каким образом этот хроматин отличается от хроматина, окружающего те же самые гены, когда они обнаруживают базовую экспрессию. В нормальных клетках или в раковых клетках, где гены транскрипционно не репрессированы, эти гены характеризуются наличием зоны открытого хроматина, где островки CpG в ДНК не метилированы, нуклеосомы расположены с нерегулярными промежутками, так что могут быть определены гиперчувствительные сайты, и ключевые гистоновые остатки маркированы посттрансляционны-ми модификациями, типичными для активных генов Активные ковалентные гистоновые метки включают в себя ацетилирование H3 по 9 и 14-му лизинам (H3K9ас and H3K14ас) и метилирование H3K4 (Nguyen et al., 2001; Fahmer et al., 2002).
Ha 5’ и 3’ границах вышеупомянутого участка открытого хроматина обнаруживается резкий переход в структуре хроматина с характерными для транскрипционно репрессированных геномных участков чертами, фланкирующими островок CpG (рис. 24.6). В этих пограничных участках имеет место метилирование менее частых сайтов CpG и рекрутирование белков, связывающихся с метилцитозином (MBDs). и их партнеров (например, деацетилаз гистонов, или HDACs) к метилированным CpGs (глава 18) Участки вне островков CpG оказываются, таким образом, доступны для ферментов, которые катализируют метки метилирования гистонов, коррелирующие с сайленсингом гена. В результате действия всех этих факторов происходит деацетилирование ключевых гистоновых остатков и обнаруживаются репрессивные метки метилирования гистонов, связанные с транскрипционной репрессией, особенно H3K9me2 (Nguyen et al., 2001; Fahmer et al., 2002; Kondo etal., 2003).
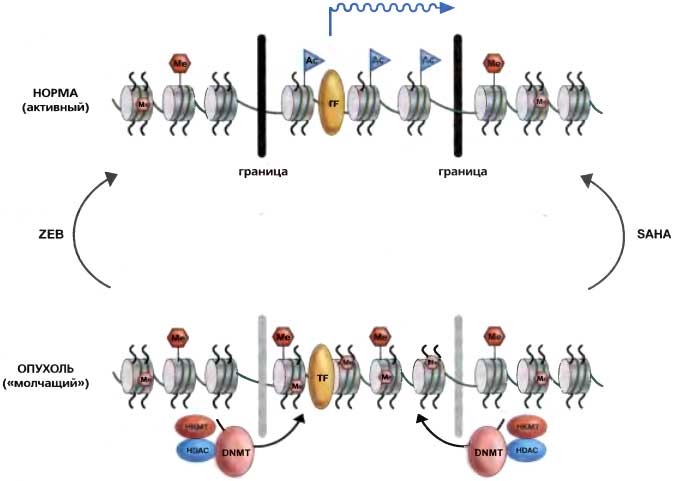
Рис. 24.6. Модель взаимоотношений между метилированием ДНК и модификациями гистонов в районе островков CpG генного промотора в нормальных и опухолевых клетках
В экспрессируемом гене показана граница (сверху), молеуклярная природа которой пока не охарактеризована и которая защищает островок CpG, окружая сайт начала транскрипции (зеленая стрелка) от метилирования ДНК. Сайты. CpG в CpG-участках, фланкирующих эту защитную зону, наоборот, имеют метилированную ДНК (розовый шестиугольник, обозначенный М) и ассоциированы с такими ключевыми метками сайленсинга, как метилирование H3K9 (красный шестиугольник, обозначенный Me). Ключевые аминокислоты «хвостов» гистонов в защищенной зоне, такие как H3K9, находятся в ацетилированом состоянии (синие флажки, обозначенные Ас) и транскрипционные факторы (желтый овал, обозначенный TF) имеют доступ к участку сайта начала транскрипции. Когда в раковой клетке тот же ген аберрантно находится в состоянии сайленсинга (внизу), островок CpG характеризуется гиперметилированием ДНК, т.к. защитные границы теперь разорваны и отсутствуют. Это метилирование поддерживается комплексами ДНК-метилтрансферазы (розовые овалы, обозначены DMMT) и белковыми комплексами, связывающимися с метилцитозином, которые содержат гистон-ацетилазы (синие овалы, обозначены HDAQ), и гистон-метилтрансферазы (красные овалы, обозначены НКМТ), которые катализируют ключевые метки метилирования при сайленсинге на аминокислотных «хвостах» гистонов (таких как H3K9). TF-комплексы более не активны (отсутствие зеленой стрелки). Отображены главные подходы проводимых в настоящее время клинических испытаний по раковой эпигенетике, которые включают либо ингибиторы метилтрансфераз ДНК для блокирования гиперметилирования ДНК, либо ингибиторы HDAC для восстановления статуса ацетилирования ключевых аминокислотных остатков гистонов Как сказано в тексте, наиболее многообещающая антираковая терапия включает комбинированное использование ингибиторов DNMT1 и HDAC
Эти соседние участки активных и репрессированных паттернов хроматина (рис. 24.6) предполагают, что промоторы активных генов, содержащие островки CpG, присущи зоне, которая «защищена», или, иными словами, не является мишенью для репрессивных меток хроматина и метилирования ДНК (Nguyen et al., 2001; Fahmer et al., 2002; Kondo et al., 2003). Неотъемлемой частью этих концепций является вероятность того, что в экспрессируемых генах молекулярные «границы» существуют на 5’ и 3’ концах промоторных островков CpG. Главная проблема — это определить точную природу этих границ. В настоящее время кандидатами на эту роль могут быть: сами модификации гистонов, которые маркируют защищенный участок промотора, транскрипционные активаторные и коактиваторные комплексы, которые прямо поддерживают активную транскрипцию, комплексы белков, которые выполняют размещение нуклеосом и(или) их движение (т.е. ремоделеры нуклеосом), которые могут маркировать гены для активной транскрипции. Эти факторы могут стимулировать доступ активирующих транскрипционных комплексов, замену классических гистонов их разновидностями, такими, как H3.3 (глава 13), который, как оказалось, поддерживает активную транскрипцию, и действие инсуляторных белковых комплексов и их узнающих последовательностей. Именно с точки зрения определения того, как один или несколько этих процессов поддерживают зоны транскрипционно пермиссивного хроматина вокруг промоторов активных генов, содержащих неметилированные по ДНК островки CpG, гены, сайленсированные при раковых заболеваниях, представляют собой великолепную модель для изучения и понимания модуляций генной экспрессии в геномах млекопитающих.
Способ, которым вышеупомянутая траскрипционно активная организация хроматина промоторов, содержащих островки CpG, преобразуется в процессе развития опухоли, остается в основном неизвестным, расшифровка этого преобразования остается одной из главных проблем в области эпигенетики рака. Как было упомянуто ранее, аномально метилированные по ДНК островки CpG в промоторах генов, сопровождающиеся генным сайленсингом, часто обнаруживаются на самых ранних и предраковых стадиях развития опухоли, делая наше понимание лежащих в основе факторов потенциально очень важным для изучения биологии рака. Это также открывает новые возможности для выявления факторов риска при раке, для облегчения ранней диагностики рака и для выдвижения новых стратегий предупреждения и раннего вмешательства в канцерогенез.
Какой бы конкретный механизм, из тех, что будут рассматриваться далее в этом разделе, не был задействован. конечным результатом, проявляющимся в процессе развития опухоли, является «разлад» механизмов, которые охраняют участки островков CpG в генном промоторе от «вторжения» хроматина репрессивного типа, расположенного на 5’ и 3’ границах. Результатом является превращение конфигурации промотора из транскрипционно открытой в закрытую с более плотно упакованными нуклеосомами и потерей гиперчувствительных сайтов, а также появление множественных состояний деацетилирования и метилирования гистонов, характерных для транскрипционно репрессивного хроматина (рис. 24.6). Иерархия всех этих событий, в том смысле, которое из них является наиболее значимым в поддержке этой репрессии, все еще нуждается в определении. Однако одна важная черта, которая всплывает из анализа множественных генов, состоит в том, что какой бы ни была роль компоненты ДНК-метилирования в инициации и (или) поддержании генного сайленсинга, однажды состоявшись, она играет доминирующую роль в наследуемости транскрипционно-репрессивного состояния. Соответственно, такие терапевтические приемы как ингибирование активности HDAC специфическими лекарственными препаратами, не могут индуцировать реэкспрессию раковых генов, промоторы которых содержат в себе плотно метилированнные островки CpG Однако, если сначала применяется низкая доза такого деметилирующего агента, как 5’-деоксиазацитидин (DAC), то затем ингибиторы HDAC обнаруживают при реэкспрессии «молчащих» генов эффект аддитивности и(или) синнергизма (Cameron et al., 1999; Suzuki et al., 2002). Данная парадигма в сочетании с использованием микрочипов для поиска, реэкспрессии сайленсных базально генов доказала свою ценность даже для идентификации новых эпигенетически сайленсированных генов при раке (Suzuki et al., 2002). Аналогично этому, реэкспрессия генов, следующая за назначением DAC, может привести к устранению меток сайленсирующего метилирования гистонов из промоторных участков эпигенетически сайленсированых раковых генов (Nguyen et al., 2001; Fahmer et al., 2002; Kondo et al., 2003). В этом смысле, как показано на рис. 24.6, метилирование ДНК может служить «замком», чтобы стабилизировать эпигенетический сайленсинг раковых генов и обеспечить его стабильное наследование, приводящее к потере функции генов.
Еще один ключевой вопрос из области эпигенетического сайленсинга раковых генов касается того, какая из DNMT ответственна за установление и поддержание аномального метилирования ДНК промотора, которое часто сопровождает этот процесс. Современные данные позволяют предполагать, что эти этапы могут быть опосредованы каким-то другим способом, нежели это можно было бы предположить, исходя из классической роли Dnmt, установленной при исследовании развития мышей. При развитии мышей, как вытекает из исследований нокаутов трех известных биологически активных ДНК-метилтрансфераз — Dnmtl, Dnmt3a и Dnmt3b — два последних фермента отвечают за установление метилирования (метилирование ДНК de novo), тогда как Dnmtl ответственна за дальнейшее поддержание установленных паттернов (поддерживающее метилирование ДНК) (Li et al., 1992; более детально см. главу 18). Однако в культуре клеток рака толстой кишки исследования по генетическому разрушению DNMTs показывают, что поддержание большинства случаев общего метилирования ДНК, в том числе гиперметилирование промоторов и сопровождающий его сайленсинг генов, требует наличия как DNMT1, так и DNMT3b (Rhee et al., 2000, 2002). Изучение раковых клеток других типов дали более разнообразные результаты — от указания на некоторую степень партнерства этих двух ферментов в таком поддержании до описания генов, которые деметилируются и транскрипционно реактивируются при уменьшении количества одной только DNMT1 (Leu et al., 2003). Таким образом, вопрос о том, как DNMTs устанавливают и поддерживают аномальные паттерны метилирования ДНК в раковых клетках, требует того, чтобы исследования были продолжены. Особенно мы нуждаемся в прояснении того, посредством каких комплексов эти ферменты могли бы кооперироваться и с помощью каких механизмов они нацеливаются на промоторы генов. Несколько последних исследований показывают, что для такого рекрутирования ключевыми являются комплексы транскрипционной репрессии (Di Croce et al., 2002; Fuks et al., 2003: Brenner et al., 2005) Каковы бы ни были эти механизмы, следует помнить, что в эксперименте DNMTs млекопитающих обладают сложными функциями, включающими не только каталитическую активность, связанную с карбокситерминальными участками в отношении метилирования ДНК, но и активность, непосредственно связанную с транскрипционной репрессией в аминотерминальных доменах (см. рис. 18.3) (Robertson et al., 2000; Rountree et al., 2000; Fuks et al., 2001). Эти ферменты также могут связываться с ключевыми медиаторами транскрипционной репрессии, в том числе с HDAC и с белками, связывающимися с метилцитозином (MBDs), и потенциально рекрутировать их. Таким образом, роль DNMT в транскрипционном сайленсинге потенциально имеет много граней (от инициации до поддерживания), которые могут включать этапы метилирования ДНК, а могут и не включать их. Сайленсинг генов при раке поможет рассортировать эти возможности.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК