6. Деацетилирование гистонов белком Sir2 обеспечивает сайты связывания для распространения SIR-комплексов
Молекулярные взаимодействия белков SIR хорошо изучены. Белок Sir4 играет роль ключевого «скелетного» фактора для их сборки. Sir4 и Sir2 активно взаимодействуют in vitro. Sir4 также независимо взаимодействует с Sir3, в то время как Sir3 и Sir2 взаимодействуют слабо (Moazed et al., 1997; Strahl-Bolsinger et al., 1997; Hoppe et al., 2002). Sir3 и Sir4 образуют также и гомодимеры (Moretti et al., 1994). При коэкспрессии в клетках насекомых Sir2, Sir3 и Sir4 образуют стабильный 360-kD комплекс, содержащий эти SIR-белки в стехиометрическом соотношении 1: 1: 1 (Cubizolles et al.. 2006). С моделью функционального гетеротримерного комплекса SIR2-3-4 согласуются и результаты исследования распределения этих трех белков в гетерохроматиновых доменах с помощью метода иммунопреципитации хроматина. Оказалось, что их содержание в разных участках гетерохроматиновых доменов одинаково (Hecht et al., 1996; Strahl-Bolsinger et al., 1997). Тем не менее, вполне очевидно, что белок Sir3 играет особую роль в распределении гетерохроматина. При суперэкспрессии Sir3 наблюдается расширение «молчащего» домена, совпадающее с распространением самого Sir3 за свою обычную границу в положении ~3 т.п.н. до -15 т.п.н. (Renauld et al., 1993; Hecht etal., 1996). Несбалансированная экспрессия одиночных Sir2 и Sir4 или даже их субдоменов имеет прямо противоположный эффект в виде нарушения ТРЕ, хотя скоординированная эктопическая экспрессия Sir3 и Sir4 противодействует дисбалансу и восстанавливает сайленсинг (Maillet et al., 1996). Все это иллюстрирует важное значение дозы белков комплекса SIR для его репрессорной функции, аналогично ситуации с комплексами Polycomb у дрозофилы. Уникальная способность Sir3 распространяться вдоль доменов хроматина при суперэкспрессии коррелирует с наблюдением, что in vitro он образует стабильные мультимеры (Liou et al., 2005).
Основа, по которой распространяется SIR-комплекс, представляет собой нуклеосомы с деацетилированными по N-концевым участкам гистонами H3 и Н4 (Braun-stein et al., 1996; Suka et al., 2001). Механизм распространения можно объяснить способом взаимодействия SIR-белков с гистонами (рис. 4.7). Белки Sir3 и Sir4 связываются с деацетилированными N-концами гистонов H3 и Н4 in vitro и in vivo (Hecht et al., 1995, 1996), причем участия хвостов H2A и Н2В для этого взаимодействия не требуется. Наиболее важная в этом отношении область гистонов — 16—29-й аминокислотные остатки гистона Н4, среди которых 16-й остаток лизина, в частности, должен быть деацетилирован (положительно заряжен) для связывания Sir3 (Johnson et al., 1990,1992). В отличие от мутаций по другим сайтам ацетилирования, даже консервативные мутации по остатку H4K16 полностью нарушают теломерный сайленсинг. Хвосты гистонов H3/Н4, и особенно область 16—24-го остатков Н4, способствуют компактизации нуклеосомных цепей in vitro, а деацетилирование H4K16 в этом случае, вероятно, регулирует наднуклеосомные уровни сворачивания нуклеосомной цепи. Как же регулируется само деацетилирование H4K16 in vivo?
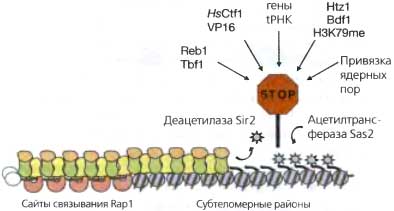
Рис. 4.7. Пограничные функции гетерохроматина у почкующихся дрожжей
Распространение гетерохроматина посредством деацетилирования белком Sir2 гистона Н4 по остатку К16 ограничивается конкурирующей активностью гистоновой ацетил-трансферазы Sas2, ацетилирующей H4K16 в прилегающем эухроматине, тем самым предотвращая связывание Sir3. Метилирование H3K79 в прилегающем эухроматине также влияет на распространение гетерохроматина. Пограничные функции могут иметь и такие факторы как Reb1, Tbf1 и белки млекопитающих и вирусов Ctf 1 и VP 16, прикрепление к ядерным порам и присутствие генов тРНК. Вполне возможно, что некоторые из них действуют, рекрутируя гистоновые ацетилтрансферазы
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК