5. Более высокие уровни организации хроматина
Хроматин, этот состоящий из ДНК и нуклеосом полимер, является динамической молекулой, существующей во многих различных конфигурациях. Ранее в течение длительного времени хроматин разделяли на эухроматин и гетерохроматин, исходя из картины окрашивания ядра красителями, которые цитологи использовали для визуализации ДНК. Эухроматин представляет собой деконденсированный хроматин, хотя он может быть активным или неактивным в отношении транскрипции. Гетерохроматин можно определить в широком смысле как высококомпактизированный и «молчащий» хроматин. Он может существовать как постоянно «молчащий» хроматин (конститутивный гетерохроматин), где гены организма лишь изредка экспрессируются в клетках любого типа, или как хроматин, репрессированный в некоторых клетках в ходе специфического клеточного цикла или на специфической стадии развития (факультативный гетерохроматин) Таким образом, имеется спектр состояний хроматина, и накопленная за многие годы литература позволяет предполагать, что хроматин является высоко динамичной структурой, склонной к ремоделингу и реструктурированию по мере получения физиологически релевантных сигналов, поступающих по «идущим вверх» (upstream) сигнальным путям. Однако лишь недавно достигнут значительный прогресс в раскрытии молекулярных механизмов, управляющих этими процессами ремоделинга.
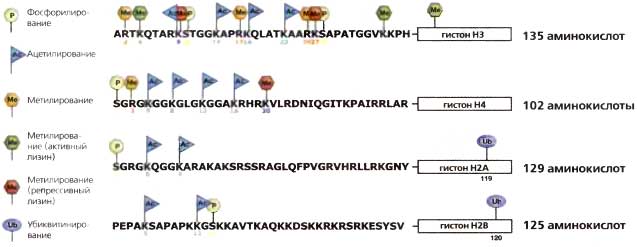
Рис. 3.6. Сайты, по которым происходят модификации гистоновых «хвостов»
Аминотерминальные «хвосты» гистонов составляют четверть массы нуклеосомы. На них находится огромное большинство известных сайтов, по которым происходит ковалентная модификация и которые изображены на рисунке. Модификации происходят также и в глобулярном домене (заключено в прямоугольник) некоторые из них указаны на рисунке. В целом в число активных меток входят ацетилирование (бирюзовый флажок Ас), метилирование аргинина (желтый шестиугольник Ме) и метилирование некоторых лизинов, таких как H3К4 и H3K36 (зеленый шестиугольник Ме). Функция H3К79 в глобулярном домене — антисайленсинг. В число репрессивных меток входят H3К9, H3К27 и H4K20 (красный шестиугольник Ме). Зеленый цвет — активная метка, красный — репрессивная метка
Фигурирующая в учебниках 11-нанометровая матрица типа «бусинок на нити» представляет собой активную и в основном «развернутую» интерфазную конфигурацию, в которой ДНК периодически оборачивается вокруг повторяющихся единиц — нуклеосом (рис. 3.7). Однако эта хроматиновая фибрилла не всегда составлена из нуклеосом, расположенных на регулярном расстоянии друг от друга. Нуклеосомы могут быть упакованы нерегулярно и могут сворачиваться в структуры более высокого порядка, анализ которых при атомном разрешении еще только начинается (Khorasanizadeh, 2004). Характерные конформации хроматина более высокого порядка возникают в разных районах генома во время спецификации судьбы клеток или на разных стадиях клеточного цикла (интерфазный vs. митотический хроматин).
Расположение нуклеосом на 11-нанометровой матрице может быть изменено в результате cis-эффектов и trans-эффектов ковалентно модифицированных «хвостов» гистонов (рис. 3.8). Cis-эффекты возникают в результате изменений в физических свойствах модифицированных хвостов гистонов, таких как модуляции в электростатическом заряде или в структуре «хвостов», которые, в свою очередь, изменяют межнуклеосомные контакты. Хорошо известным примером может служить ацетилирование гистонов, которое, как давно подозревали, нейтрализует положительные заряды сильно основных гистоновых «хвостов», порождая в результате локальное растяжение хроматиновой фибриллы и тем самым обеспечивая лучший доступ транскрипционной машины к двойной спирали ДНК. Фосфорилирование, благодаря добавлению суммарного отрицательного заряда, может создавать «очажки зарядов» [charge patches] (Dou and Gorovsky, 2000), которые, как полагают, изменяют упаковку нуклеосом или экспонируют аминоконцы гистонов, изменяя у хроматинового полимера состояние сворачивания более высокого порядка (Wei et al., 1999; Nowak and Corces, 2004). Считается, что во многом таким же образом линкерные гистоны (Н1) стимулируют упаковку фибрилл более высокого порядка, экранируя отрицательный заряд линкерной ДНК между соседними нуклеосомами (Thomas, 1999; Khochbin, 2001; Harvey and Downs, 2004; Kimmins and Sassone-Corsi, 2005). Добавление таких объемистых аддуктов, как убиквитин и АДФ-рибоза, также может индуцировать разное расположение гистоновых «хвостов» и открывать группы нуклеосом. В какой мере гистоновые «хвосты» могут индуцировать компактизацию хроматина посредством механизмов, зависящих от модификаций и не зависящих от них, — еще не ясно.
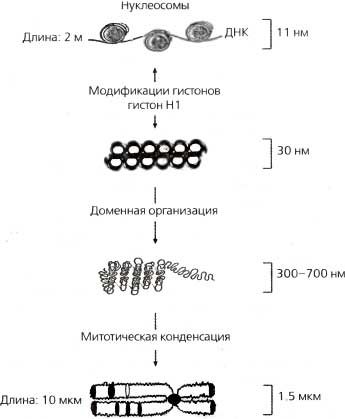
Рис. 3.7. Структурирование хроматина более высоких порядков
11-нанометровая фибрилла представляет собой ДНК, накрученную вокруг нуклеосом 30-нанометровая фибрилла компактизирован а далее во все еще неподтвержденную структуру (изображена здесь как соленоидная конформация), включающую линкерный гистон Н1. 300—700-нанометровое волокно представляет собой динамическое «выпетливание» более высокого порядка, которое обнаруживается как в интерфазном, так и в метафазном хроматине. 1,5-микрометровая конденсированная хромосома представляет собой наиболее компакгизированную форму хроматина, которая обнаруживается только во время ядерного деления (митоза или мейоза). Еще не ясно, каким образом картины бэндинга (т. е. G- или R-бэндинга) митотической хромосомы коррелируют с конкретными структурами хроматина
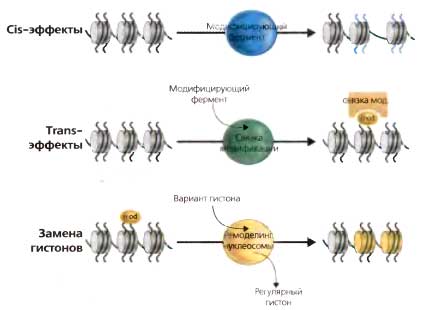
Рис. 3.8. Переходы в хроматиновой матрице (cis/trans)
cis-эффекты: ковалентная модификация остатка гистонового «хвоста» приводит к изменению структуры или заряда, проявляющемуся как изменение в организации хроматина, trans-эффекты: ферментативная модификация остатка гистонового «хвоста» (напр., метилирование H3К9) приводит к возникновению сродства к ассоциированному с хроматином белку (modbinder, напр., НР1). Ассоциация mod binder (или комплексов ассоциированных белков) вызывает изменения в структуре хроматина «вниз по течению». Замещение гистонов: ковалентная модификация гистонов (или другой стимул) может послужить сигналом для замещения какого-то корового гистона вариантным гистоном с помощью комплекса-обменника, осуществляющего ремоделинг нуклеосом
Модификации гистонов могут также вызывать то, что мы обозначаем как trans-эффекты, рекрутируя в хроматин связанные с модификацией молекулы-партнеры. Это может рассматриваться как «считывание» конкретной ковалентной метки гистона зависимым от контекста образом. Некоторые партнеры по связыванию обладают особым сродством и поэтому говорят, что они «помещаются как в док» («dock») на специфические «хвосты» гистона и нередко делают это, играя роль хроматиновой «застежки-липучки» («Velcro») для одного полипептида в составе значительно более крупного ферментативного комплекса, которому нужно связаться с хроматиновым полимером. Например, бромодомен — мотив, распознающий ацетилированные остатки гистона — часто, хотя и не всегда, является частью фермента ацетилтрансферазы гистонов (HAT), функция которого — ацетилирование гистонов-мишеней (см. рис. 3.10 в разделе 7) и который существует как часть более крупного комплекса, осуществляющего ремоделинг хроматина (Dhalluin et al. 1999; Jacobson et al. 2000). Аналогичным образом метилированные остатки лизина, встроенные в гистоновые «хвосты», могут считываться хромодоменами (Bannister et al., 2001; Lachner et al., 2001; Nakayama et al., 2001) или сходными доменами (например, МВТ, tudor) (Maurer-Stroh et al., 2003; Kim et al., 2006) и облегчать модуляции хроматина, происходящие «ниже по течению». В некоторых случаях, например, ассоциация хромодоменных белков ускоряет распространение гетерохроматина путем катализируемого гистоновой метилтрансферазой (HKMT) метилирования соседних гистонов, которые затем считываются хромодоменными белками (глава 5).
Модификации как «хвостовых» участков, так и глобулярного корового участка гистонов (Cosgrove et al., 2004) могут также «нацеливать» зависимые от АТФ ремоделирующие комплексы на 11-нанометровую фибриллу, необходимую для перехода от готового к действию эухроматина к транскрипционно активному состоянию. Эта мобилизация нуклеосом может происходить путем скольжения октамера, изменения структуры нуклеосомы в результате выпетливания ДНК (детали см. в главе 12) или замещения специфических коровых гистонов гистоновыми вариантами (глава 13). Зависимые от АТФ ремоделеры хроматина (такие как SWI/SNE — исторически важный пример!) путем гидролиза высвобождают энергию для того, чтобы осуществить значительные изменения в контактах гистон: ДНК, приводящие к выпетливанию, скручиванию и скольжению нуклеосом. Как было показано, эти нековалентные механизмы имеют критически важное значение для событий регуляции генов (Narlikar et al., 2002) в такой же мере, как и механизмы, связанные с ковалентной модификацией гистонов (глава 10). Тот факт, что специфические зависимые от АТФ ремоделеры могут перетасовывать варианты гистонов, включая их в хроматин и выводя их из него, дает возможность связать вместе с is-, trans-механизмы и механизмы ремоделинга. В свою очередь, понимание того, как эти взаимосвязанные механизмы действуют согласованным образом, варьируя эпигенетические состояния в хроматине все еще остается далеко не полным.
Более компактные и репрессивные хроматиновые структуры более высокого порядка (30-нанометровые) могут быть также получены в результате рекрутирования линкерного гистона Н1 и (или) зависящих от модификации, или «архитектурных», факторов, связанных с хроматином, — таких, как белок 1 гетерохроматина (НР1) или Polycomb (PC). Хотя обычно считают, что компактизация нуклеосомного хроматина (11-нанометрового) в 30-нанометровую транскрипционно некомпетентную конформацию осуществляется путем включения линкерного гистона Н1 в интерфазе, функциональное и структурное расчленение этого гистона до недавнего времени было затруднено (Fan et al., 2005). Одна вероятная проблема, связанная с этими исследованиями, заключается в том, что гистон Н1 существует в виде разных изоформ (около 8 у млекопитающих), затрудняя проведение детального генетического анализа. Таким образом, имеет место дублирование между некоторыми изоформами Н1, тогда как другие изоформы могут выполнять тканеспецифичные функции (Kimmins and Sassone-Corsi, 2005). Интересно, что сам Н1 может быть ковалентно модифицирован (фосфорилирован, метилирован, поли(АТФ)рибозилирован и т. д.), создавая возможность того, что cis- и trans-механизмы, проанализированные в настоящее время на коровых гистонах, вполне могут быть распространены и на этот важный класс линкерного гистона, а также на негистоновые белки (Sterner and Berger, 2000).
Значительные споры имели место по вопросу о деталях того, каким образом организована 30-нанометровая фибрилла хроматина. В целом были описаны либо «соленоидные» (одностартовая спираль) модели, в которых нуклеосомы постепенно сворачиваются вокруг центральной оси (6–8 нуклеосом на один оборот), либо более открытые модели типа «зигзага», предполагающие самосборку более высокого порядка (двухстартовая спираль). Новые данные, в том числе данные рентгеноструктурного анализа с использованием модельной системы, содержащей четыре нуклеосомы, позволяют предполагать такую организацию фибриллы, которая в большей мере согласуется с двухстартовой, зигзагообразной конформацией линкерной ДНК, соединяющей две стопки нуклеосомных частиц (Khorasanizadeh, 2004; Schalch et al., 2005). Несмотря на этот прогресс, мы отмечаем, что линкерный гистон не присутствует в действительно существующих [current] структурах и даже если бы он там присутствовал, 30-нанометровая хроматиновая фибрилла компактизирует ДНК всего лишь примерно в 50 раз. Таким образом, в организации хроматина существует значительно больше уровней более высокого порядка, которые еще предстоит различить за рамками свето- и электронно-микроскопического исследования и которые обусловливают либо интерфазное, либо митотическое состояния хроматина. Недавние результаты, полученные на живых клетках, несмотря на некоторую структурную неопределенность, уже выявили в интерфазных хромосомах существование множественных уровней сворачивания хроматина выше уровня 30-нанометровой фибриллы. Заслуживающим внимания достижением было развитие новых подходов, позволяющих метить специфические нуклеотидные последовательности ДНК в живых клетках, что создает возможность изучать динамику «открытия» и «закрытия» хроматина in vivo в реальном времени. Интересно, что эти результаты выявляют динамическое взаимодействие позитивных и негативных факторов ремоделинга хроматина в установлении хроматиновых структур более высокого порядка для состояний, в большей или меньшей мере совместимых с экспрессией генов (Fisher and Merkenschlager, 2002; Felsenfeld and Groudin, 2003; Misteli, 2004).
Имеет место организация в более крупные петлевидные хроматиновые домены (300–700 нм), возможно путем заякоривания хроматиновой фибриллы на периферии ядра или на других ядерных скаффолдах (остовах) с помощью таких ассоциированных с хроматином белков, как ядерные ламины Остается неясным, в какой степени эти ассоциации дают начало значимым [meaningful] «хромосомным территориям», но многочисленные сообщения показывают, что эта концепция заслуживает серьезного внимания. Например, наблюдали образование кластеров множественных сайтов активного хроматина с транскрипционными факторами РНК-полимеразы II (RNA pol II); аналогичные концепции, по-видимому, приложимы к образованию кластеров вокруг реплицирующейся ДНК и ДНК-полимеразы. Напротив, образование кластеров «молчащего» гетерохроматина (в особенности перицентромерных фокусов) и генов, локализованных в trans-положении, также было документировано (главы 4 и 21). Каким образом эти ассоциации контролируются и насколько ядерная локализация хроматиновых доменов затрагивает регуляцию генома — еще не ясно. Тем не менее, все большее количество данных показывает наличие корреляций активной или «молчащей» конфигурации хроматина с определенной ядерной территорией (Cremer and Cremer, 2001; Gilbert et al., 2004; Janicki et al., 2004; Chakalova et al., 2005).
Наиболее конденсированная структура ДНК наблюдается на стадии метафазы митоза или мейоза. Это делает возможным надежное расхождение, с помощью хромосом, точных копий нашего генома (одной или двух копий каждой хромосомы, в зависимости от наблюдаемого типа деления) в каждую дочернюю клетку. Эта конденсация связана с серьезным реструктурированием ДНК из состояния двухметровой, полностью растянутой молекулы в состояние дискретных хромосом размером в среднем 1,5 мкм в диаметре (рис. 3.7). Это не меньше, чем 10 000-кратная компактизация и она достигается путем гиперфосфорилирования линкерного (Н1) и корового гистона H3 и зависящего от АТФ действия конденсиновых и когезиновых комплексов и топоизомеразы II. Остается еще определить, как конкретно негистоновые комплексы затрагивают митотический хроматин (или модификации хроматина фазы М) и по каким правилам происходит (зависимым от клеточного цикла образом) их ассоциация с хроматином и высвобождение из него (Bernard et al., 2001; Watanabe et al., 2001). Здесь может оказаться важным хорошо известное митотическое фосфорилирование гистона H3 (т. е. серинов 10 и 28) и членов семейства Н1, но полного понимания того, в чем заключается функция этих митотических меток, предстоит еще достичь в генетических и биохимических экспериментах. Интересно, что была предложена формальная теория, согласно которой специфические метки, обусловленные метилированием, при сочетании с более динамичными и обратимыми метками, обусловленными фосфорилированием, могут действовать в гистоновых белках как «двоичный переключатель», управляя связыванием и высвобождением эффекторов, находящихся «вниз по течению» и затрагивающих хроматиновую матрицу (Fischle et al., 2003а). Используя связывание НР1 с метилированным по лизину 9 гистоном H3 (H3К9ше) и митотическое фосфорилирование серина 10 (H3S10ph), недавно получили данные в поддержку митотического «метил/фос-переключателя» (Daujat et al., 2005; Fischle et al., 2005; Hirota et al., 2005).
Такие специализированные хромосомные домены, как теломеры и центромеры, выполняют другие функции, направленные на динамику хромосом как таковую. Теломеры действуют как хромосомные концы, обеспечивая защиту и уникальное решение проблемы репликации самых кончиков молекул ДНК. Центромеры обеспечивают места прикрепления для микротрубочек веретена во время деления ядра. Оба этих специализированных домена играют фундаментальную роль в событиях, приводящих к надежному расхождению хромосом. Интересно, что и теломерный, и центромерный гетерохроматин отличается от эухроматина и даже других гетерохроматиновых районов (см. ниже) присутствием уникальных хроматиновых структур, которые в основном оказывают репрессивное действие на активность генов и рекомбинацию. Перемещение экспрессируемых генов из их нормального положения в эухроматине в новое положение в центромерном и теломерном гетерохроматине или поблизости от него (главы 4–6) может заставить эти гены «замолчать», создавая возможность описанного ранее скрининга для поиска и идентификации супрессоров или энхансеров эффекта положения мозаичного типа (PEV) или эффектов прителомерного положения (ТРЕ, telomere-position effects; Gottschling et al., 1990; Aparicio et al., 1991). Центромеры и теломеры имеют молекулярные сигнатуры, в том числе, например, гипоацетилированные гистоны. Интересно, что центромеры «маркированы» также присутствием гистонового варианта CENP-A, играющего активную роль в сегрегации хромосом (глава 14). Таким образом, правильная сборка и поддержание различающихся центромерного и перицентромерного гетерохроматина являются критичными для завершения митоза или мейоза и, отсюда, для жизнеспособности клеток. В дополнение к хорошо изученным центромерной и перицентромерной формам конститутивного гетерохроматина успешно исследуются механизмы эпигенетического контроля центромерной (и теломерной) «идентичности». Остроумными экспериментами удалось показать, что вместо нормальных центромер могут функционировать «неоцентромеры», демонстрируя тем самым, что идентичность центромер не диктуется нуклеотидными последовательностями ДНК (главы 13 и
14). Вместо этого данный специализированный хромосомный домен маркируют эпигенетические особенности [hallmarks], в том числе паттерны специфичных для центромер модификаций и варианты гистонов. В вопросе о том, каким образом другие кодирующие, не кодирующие и повторяющиеся участки хроматина вносят свой вклад в эти эпигенетические сигнатуры, достигнут значительный прогресс. Как те или иные из этих механизмов соотносятся (если соотносятся вообще) с паттернами бэндинга хромосом — неизвестно, но остается интригующей возможностью. Необходимо достичь понимания того, как эпигенетически регулируются эти части уникальных хромосомных районов, особенно в свете того, что многочисленные виды рака у человека характеризуются геномной нестабильностью, которая является маркером прогрессии некоторых заболеваний и неоплазии.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК