1.3. Центромеры дробянковых дрожжей состоят из разных гетерохроматиновых и центральных кинетохорных доменов
У дробянковых дрожжей разница в качестве сайленсинга по длине центромер отражает тот факт, что репрессия транскрипции является результатом разных хроматиновых структур, включая ассоциации различных негистоновых белков, во внешних повторах и в центральном домене (Partridge et al., 2000). Имеются две разные хроматиновые структуры, которые были охарактеризованы в центромерных районах дробянковых дрожжей: гетерохроматин над участками внешних повторов и хроматин «CENP-А», покрывающий центральный домен, где собирается кинетохор. В этих двух доменах с сайленсингом репортерных генов связаны (и для него требуются) разные белки.
Гетерохроматин
В хроматине аминотерминальные «хвосты» гистонов H3 и Н4 подвержены ряду посттрансляционных модификаций, которые обычно коррелируют с активными или репрессивными состояниями (глава 3). Центромерный гетерохроматин во внешних повторах ассоциируется с ди- и триметильными состояниями гистона H3 по лизину 9 (H3K9me2 и H3K9me3) (Nakayama et al., 2001; Yamada et al., 2005). Для формирования центромерного гетерохроматина требуется действие нескольких белков, модифицирующих хроматин и, тем самым, стимулирующих связывание других факторов. Для формирования гетерохроматина сначала требуются деацетилазы гистонов (HDACs; такие как ClrЗ, Clr6 и Sir2), чтобы деацетилировать гистон H3. Это впоследствии позволяет метил-трансферазе лизина гистонов (HKMT) Clr4 метилировать гистон H3 по лизину 9 над центромерными внешними повторами. Эта модификация создает специфический сайт связывания, который распознается хромодоменным мотивом, присутствующим в Swi6 и Chp2 (гомологах гетерохроматинового белка 1 [НР1], описываемого в главе 5) и в еще одном хромодоменном белке Chp1 (рис. 6.26). Все эти белки вносят вклад в формирование «молчащего» хроматина над внешними повторами (Allshire et al., 1995; Cowieson et al., 2000; Partridge et al., 2000; Bannister et al., 2001; Nakayama et al., 2001; Shankaranarayana et al., 2003; Sadaie et al., 2004).
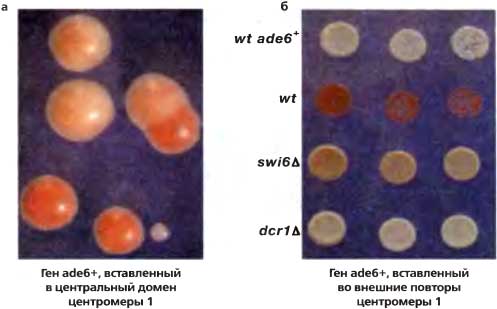
Рис. 6.3. Мозаицизм и облегчение сайленсинга маркерных генов
(а) Экспрессия ade6+ из центрального домена носит мозаичный характер, давая в результате красные, белые и секторированные колонии. Клетки, экспрессирующие ade6+, образуют белые колонии; когда же ade6+ репрессирован, образуются красные колонии, (б) ade6+, вставленный во внешние повторы, накрепко сайленсирован, что в результате дает однородные красные колонии. Для этого сайленсинга требуются белки гетерохроматина, такие как Swi6 (который связывается с метилированным H3K9). и компоненты RNAi, такие как Dcr1 (Dicer, РНКаза-III-рибонуклеаза)
Хроматин, ассоциированный со вставками репортерного гена во внешние повторы (например, гена ura4+), заметно обогащен белками H3K9me2 и Swi6. Это показывает, что модификация хроматина и Swi6 могут распространяться из соседней центромерной повторяющейся ДНК в вклинивающиеся [interposing] последовательности (Cowieson et al., 2000; Nakayama et al., 2001). Локализация Swi6 и сайленсинг зависят от метилирования H3K9, что иллюстрируется нарушением локализации Swi6 в клетках, у которых нет специфичной для H3K9 HKMT, Clr4, или у мутантов по H3, где лизин 9 замещен аргинином (Ekwall et al., 1996; Mellone et al., 2003). Белок Swi6 димеризуется через свой «chromoshadow»-домен (Cowieson et al., 2000) и это, вероятно, облегчает его распространение вдоль хроматиновых фибрилл, которому способствует последовательное действие HDACs и специфичной для H3K9 HKMT Clr4.
Кроме Swi6, с хроматином внешних повторов в центромерах ассоциируются также хромодоменные белки Chp1 и Chp2 путем связывания гистона H3, метилированного по лизину 9. Было показано, что Chp1 является компонентом эффекторного комплекса RNAi, RITS (глава 8), и необходим для полного метилирования гистона H3K9 над внешними повторами и вставленными репортерными генами (Partridge et al., 2002; Motamedi et al., 2004; Sadaie et al., 2004).
Хроматин центрального кинетохорного домена
Прежде чем обсуждать детали формирования гетерохроматина на внешних повторах в центромерах, важно принять во внимание, что хроматин центрального домена, где собирается кинетохор, очень отличается от гетерохроматина, фланкирующего внешние повторы, потому что именно там собирается кинетохор. В противоположность сайленсингу во внешних повторах сайленсинг репортерных генов в центральном домене сеп 1 (имеющем длину приблизительно 10 т.о.), по существу, не зависит от Clr4 и поэтому не связан с метилированием гистона H3 по лизину 9. Действительно, было показано, что центральный домен обладает отличающимся составом хроматина. Первоначально это было продемонстрировано в ходе анализа с использованием микрококковой нуклеазы, MNase (объяснение ее действия см. в главе 5), когда обнаружили «мазок» [smear] в противоположность регулярной «лесенке» с интервалом 150 п.н., характерной для хроматина фланкирующих внешних повторов (Polizzi and Clarke, 1991; Takahashi et al., 1992). Этот особый паттерн отличает хроматин центрального домена от гетерохроматина и эухроматина и имеет отношение к его сборке в особом CENP-A-хроматине и сборке кинетохора над этим районом. У всех изученных эукариот с активными центромерами специфически связывается белок, подобный гистону H3 и известный как CTNP-A (или сепH3), (Cleveland et al., 2003), а CENP-A-хроматин играет решающую роль в определении места сборки кинетохора (рис. 6.26).
В хроматине центрального домена центромер у дробянковых дрожжей большая часть гистона H3 замещена ортологом CENP-A, известным как Cnp1 (рис. 6.46) (Takahashi et al., 2000). Откладка CENP-ACnp1 может происходить зависимым от репликации образом в фазе S или независимым от репликации способом в G2 (дополнительные детали см. в главе 13). Кинетохорные белки сами управляют локализацией и сборкой CENP-ACnp1 специфически в пределах центрального домена центромеры (Goshima et al., 1999; Takahashi et al., 2000; Pidoux et al., 2003). Ams2 (фактор GATA), например, управляет связанной с репликацией откладкой CENP-ACnp1 в фазе S. В его отсутствие независимая от репликации откладка с помощью Mis6 в G2 может обеспечивать компенсацию, доводя уровни CENP-ACnp1 до максимума в интерфазе (Chen et al., 2003; Takahashi et al., 2005). Если структура хроматина CENP-ACnp1 разрушается (как в случае мутантов cnpl, mal2, mis6, sim4 и других), специфический «смазанный» паттерн, получаемый при обработке ми-крококковой нуклеазой, превращается в паттерн, более типичный для основной массы хроматина (т.е. в нуклеосомную «лесенку»). Мутанты, затрагивающие хроматин центрального домена, не оказывают никакого заметного влияния на сайленсинг во внешних повторах (Cowieson et al., 2000; Jin et al., 2002; Pidoux et al., 2003; Hayashi et al., 2004). Более того, тот факт, что CENP-ACnp1, Ма12, Mis6, Sim4 и другие кинетохорные белки связываются только с центральным доменом, показывает, что центральный кинетохорный домен является структурно сложным и функционально отличается от «молчащего» хроматина внешних повторов (рис. 6.26).
Были протестированы не все белки кинетохорного домена, но создается впечатление, что сайленсинг в центральном домене является результатом сборки интактного кинетохора, который, как и у S. cerevisiae, включает по меньшей мере 50 белков (Measday and Hieter, 2004). Этот крупный комплекс белков предположительно ограничивает доступ РНК-полимеразы II к репортерным генам, помешенным в этот район, и тем самым тормозит их транскрипцию. У таких мутантов, как cnpl, mal2, mis6 и sim4, при пермиссивной температуре целостность кинетохора, несомненно, частично нарушена, и это делает возможной увеличенную транскрипцию репортерных генов. Побочный результат этого состоит в том, что в норме «молчаший» репортерный ген был использован для тестирования дефектов в хроматине центрального кора, что привело к идентификации новых кинетохорных белков (Pidoux et al., 2003).
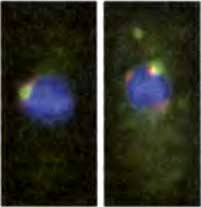
Рис. 6.4. «Молчащий» хроматин в ядрах S. pombe
Два интерфазных ядра с гетерохроматином (центромеры, теломеры и «молчащие» локусы mat2-mat3), декорированных красной флуоресцентной иммунолокализацией Swi6, и кинетохорный хроматин (только центромеры), декорированный зеленой флуоресцентной иммунолокализацией CENP-ACnp1. Красные сигналы не в самом соседстве с зелеными представляют теломеры или mat2-mat3. Все нентромеры собраны в кластер на периферии ядра рядом с организующим центром митотического веретена
Центромерные районы не полностью лишены генов, и любопытно, что несколько генов тРНК находятся между внешними повторами и центральным кинетохорным районом (рис. 6.2а) (Kuhn et al., 1991; Takahashi et al., 1991). Недавно было показано, что они действуют как барьер, предотвращая вторжение гетерохроматина в центральный домен (Scott et al., 2006).
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК